
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 30. Елементи VIIIB групи 2 страница
B) 93,1%;
C) 75,0%;
D) 93,6%;
E) 57,0%.
6.87. Вкажіть речовини, які людство почало використовувати першими:
A) мідь і її сплави;
B) залізо;
C) срібло та його сплави;
D) ртуть;
E) золото.
6.88. Вкажіть метали, що зустрічаються в природі у самородному стані:
A) золото і срібло;
B) залізо і хром;
C) калій і натрій;
D) магній і кальцій;
E) жодна відповідь не правильна.
6.89. Встановіть відповідність між металом і його вищим хлоридом:
A) Cu; 1) AuCl3;
B) Ag; 2) AgCl2;
C) Au. 3) CuCl2.
6.90. Встановіть відповідність між назвою речовини та її хімічною формулою:
A) халькопірит; 1) AuTe2;
B) малахіт; 2) Ag2S;
C) аргентит; 3) CuFeS2;
D) калаверит; 4) Cu2(OH)2CO3;
E) мідний купорос. 5) CuSO4∙5H2O.
6.91. Закінчіть рівняння реакції, розставте коефіцієнти:
Au + NaCN + ____H2O + O2 →_________ + ___NaOH
6.92. Закінчіть рівняння реакції, розставте коефіцієнти:
Au + HNO3 + ___HCl → _________+ ________↑+ ____H2O
6.93. Вкажіть осад, який утворюється при взаємодії іонів Арґентуму з хлоридною кислотою та розчинними хлоридами:
A) білий сирнистий осад;
B) світло-жовтий осад;
C) безбарвний осад;
D) темно-синій осад;
E) блакитний осад.
6.94. Вкажіть речовини, в розчинах яких розчиняється золото:
A) H2SO4(конц.);
B) HCl(конц.)+ HNO3(конц.)
C) HNO3(конц.);
D) 90% NaOH;
E) 10% Ca(OH)2.
6.95. Закінчіть рівняння реакції, розставте коефіцієнти:
___Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + _________
6.96. Вкажіть, де в організмі людини зосереджено найбільший вміст Купруму:
A) кістках;
B) жовчному міхурі;
C) печінці;
D) судинах;
E) мозку.
6.97. Визначте масу осаду, що утворюється при зливанні розчинів натрій хлориду і арґентум нітрату масою по 400 г, у яких масова частка розчинених речовин становить по 10 %:
A) 30 г;
B) 40 г;
C) 40,8 г;
D) 97,58 г;
E) 34 г.
6.98. Визначте масу міді, що можна добути купрум (ІІ) оксиду відновленням воднем об'ємом 2,8 л (н.у.):
A) 32 г;
B) 8 г;
C) 64 г;
D) 6,4 г;
E) 9 г.
6.99. Визначте об'єм газу (в літрах за н.у.), що виділяється при взаємодії аурум (ІІІ) хлориду з гідроген пероксидом у розчині калій гідроксиду, якщо при цьому утворюється 5,91 г золота:
A) 1 л;
B) 2 л;
C) 0,4 л;
D) 1,5 л;
E) 1,7 л.
6.100. Вкажіть, яку ступінь окиснення (в більшості випадків) у сполуках виявляють елементи підгрупи Цинку:
A) +5;
B) +2;
C) -1;
D) +3;
E) -2.
6.101. Вкажіть, як змінюється активність елементів підгрупи Цинку:
A) зменшується зверху вниз;
B) збільшується зверху вниз;
C) зменшується знизу вгору;
D) збільшується знизу вгору;
E) не змінюється.
6.102. Вкажіть, в яких органах людського організму накопичується Цинк:
A) кістках;
B) головному мозку;
C) печінці;
D) жовчному міхурі;
E) зубах.
6.103. Вкажіть, які фізичні властивості характерні для металів підгрупи Цинку:
A) м'який метал;
B) стійкість проти дії повітря;
C) сріблястий метал;
D) отруйні метали;
E) голубовато-сріблястий блиск.
6.104. Вкажіть, скільки відомо ізотопів Кадмію:
A) 5;
B) 7;
C) 3;
D) 6;
E) 8.
6.105. Виберіть правильні відповіді, які характеризують елементи підгрупи Цинку:
A) кадмій неактивний метал;
B) здатність Кадмію до комплексоутворення вища, ніж Цинку;
C) природний Цинк – це суміш чотирьох стабільних ізотопів;
D) сполуки Меркурію легко відновлюються;
E) ртуть виявляє підвищену активність до дії галогенів.
6.106. Закінчіть рівняння реакції, розставте коефіцієнти:
Zn + ___HCl + ___H2O → _________ + H2↑
6.107. Закінчіть рівняння реакції, розставте коефіцієнти:
___CdS + ___HNO3 → ___Cd(NO3)2 + _____↑ + _____↓ + ___H2O
6.108. Закінчіть рівняння реакції, розставте коефіцієнти:
Hg(NO3)2 + ___KІ → ______ + ______↓ + ___KNO3
6.109. Закінчіть рівняння реакції, розставте коефіцієнти:
____HgS + ____HNO3 + ____HCl → ______ + ___H2SO4 + ______↑ + _______
6.110. Вкажіть формулу мінералу титаномагнетиту:
A) TiO2;
B) FeTiO3∙nFe3O4;
C) FeTiO3;
D) ZrSiO4;
E) ZrO2.
6.111. Вкажіть найхарактернішу ступінь окиснення для всіх елементів IV В групи:
A) +4;
B) +2;
C) -2;
D) +3;
E) +5.
6.112. Виберіть правильні відповіді для характеристики простих речовин елементів підгрупи Титану:
A) на холоді хімічно малоактивні;
B) стійкі проти корозії на повітрі;
C) під час нагрівання активність цих металів знижується;
D) титан та його аналоги за кімнатної температури здатні повільно взаємодіяти з концентрованою фторидною кислотою;
E) оксиди Титану, Цирконію, Гафнію (ЕО2) – амфотерні.
6.113. Виберіть правильні відповіді для характеристики елементів підгрупи Титану:
A) за властивостями Цирконій і Гафній дуже подібні;
B) від Ti до Zr атомні радіуси дещо збільшуються;
C) від Ti до Zr атомні радіуси дещо зменшуються;
D) від Ti до Zr іонні радіуси елементів дещо зменшуються;
E) елементи підгрупи Титану перебувають у природі тільки у вигляді сполук.
6.114. Закінчіть рівняння реакції, розставте коефіцієнти:
___TiOCl2 + Zn + ___HCl → _____ + _______ + ____H2O
6.115. Закінчіть рівняння реакції, розставте коефіцієнти:
____Ti + ____HF → _______+ ___H2↑
6.116. Закінчіть рівняння реакції, розставте коефіцієнти:
ZrO2 + CaCO3 → __________ + CO2↑
6.117. Закінчіть рівняння реакції, розставте коефіцієнти:
HfF4 + ___NaF→ __________
6.118. Вкажіть, де застосовуються сполуки підгрупи Титану:
A) в ювелірній промисловості;
B) в техніці;
C) в медицині;
D) в сільському господарстві;
E) в фармації.
6.119. Визначте, як змінюються в ряду Ti – Zr – Hf значення радіусів атомів (р.а.) та енергія іонізації (ЕІ):
A) р.а. зменшується, ЕІ зменшується;
B) р.а. збільшується, ЕІ зменшується;
C) р.а. збільшується, ЕІ зростає;
D) р.а. зменшується, ЕІ зростає;
E) р.а. збільшується, ЕІ не змінюється.
6.120. Виберіть правильні відповіді для характеристики елементів підгрупи Ванадію:
A) зі збільшенням протонного числа елементів радіуси атомів зростають незначною мірою, у Ніобію і Танталу вони однакові, тому Nb і Ta за властивостями більш подібні один до одного, ніж до Ванадію;
B) ці елементи є неметалами;
C) природний Ванадій є сумішшю чотирьох нуклідів;
D) Ніобій моноізотопний елемент;
E) V, Nb, Ta – сріблясто-білі метали, тверді, пластичні, мають високу механічну міцність.
6.121. Закінчіть рівняння реакції і визначте коефіцієнти:
____Ta + ____HNO3 + ___HF→_________ + ___NO↑ + ___H2O
6.122. Закінчіть рівняння реакції, розставте коефіцієнти:
__Nb + ____H2SO4 → __________ + ____SO2↑ + ___H2O
6.123. Закінчіть рівняння реакції, розставте коефіцієнти:
___V + ___HNO3 + ___HF → ________ + ___NO↑ + ___H2O
6.124. Закінчіть рівняння реакції, розставте коефіцієнти:
V2O5 + ___HCl → _______ + Cl2↑ + ___H2O
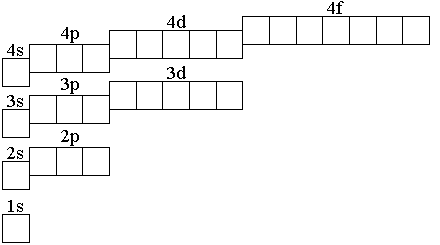
6.125. Позначте стрілками електрони в графічній схемі електронної будови атома Cr:
6.126. Позначте стрілками електрони в графічній схемі електронної будови атома Mo:
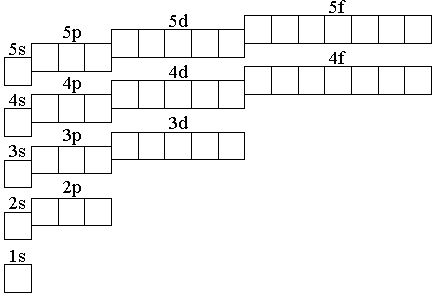
6.127. Вкажіть властивості хрому:
A) жовтий пластичний;
B) м’який;
C) має густину в два рази більшу за залізо;
D) сіро-сталевий зі сріблястими блискітками в місці зламу;
E) твердий.
6.128. Вкажіть елемент з найбільшим діаметром атому:
A) Cr;
B) Fe;
C) Mn;
D) Mo;
E) W.
6.129. Вкажіть максимально можливу валентність Mo:
A) 7;
B) 8;
C) 6;
D) 10;
E) 11.
6.130. Вкажіть метал з найвищою температурою плавлення:
A) Cr;
B) Mo;
C) Nb;
D) V;
E) W.
6.131. Закінчіть рівняння реакції, розставте коефіцієнти: Cr2O3 + Al®_____ + ___
6.132. Знайдіть відповідність між сполукою та її кольором:
A) [Cr[(H2O)6]Cl3; 1) жовтий;
B) Cr2O3; 2) зелений;
C) K2Cr2O7; 3) синьо-фіолетовий;
D) K2CrO4. 4)червоний.
6.133. Вкажіть ступінь окиснення Хрому у сполуках
A) (NH4)2Cr2O7 ____
B) Cr(CO)6 ____
C) Fe(CrO2)2 ____
D) K2CrO4 ____
E) KCrO3Cl ____
6.134. Встановіть відповідність між формулою та назвою сполуки:
A) K2Cr2O7; 1) калій хромат;
B) K2Cr3O10; 2) калій дихромат;
C) K2Cr4O13; 3) калій трихромат;
D) K2CrO4; 4) калій тетрахромат;
E) KCrO2. 5) калій хроміт.
6.135. Напишіть графічну формулу хроматної кислоти:
__________________________________________________________
6.136. Вкажіть метали, які не реагують з концентрованою нітратною кислотою при температурі 0°С:
A) Al;
B) Cr;
C) Cu;
D) K;
E) Zn.
6.137. Вкажіть pH та [OH-] водного розчину Cr2(SO4)3:
A) [OH-]<10-7;
B) [OH-] = 10-7;.
C) [OH-]>10-7;
D) pH<7;
E) pH = 7;
F) pH>7.
6.138. Вкажіть сполуку хрому, яка проявляє амфотерні властивості:
A) Cr(OH)2;
B) Cr2O3;
C) CrO;
D) CrO3;
E) Na2CrO4.
6.139. Вкажіть формулу хром (VI) оксиду-дипероксиду:
A) Cr2O3;
B) CrO;
C) CrO3;
D) CrO5;
E) CrO6.
6.140. Розставте оксиди в порядку зростання їх кислотних властивостей:
A) Cr2O3;
B) CrO;
C) CrO3;
D) MoO3;
E) WO3.
6.141. Вкажіть, які метали за нормальних умов не реагують з розбавленими сульфатною та хлоридною кислотами:
A) цинк;
B) вольфрам;
C) молібден;
D) титан;
E) хром.
6.142. Вкажіть сполуки, які утворюються при термічному розкладанні амоній дихромату:
A) Cr2O3;
B) CrO3
C) H2O;
D) N2;
E) NO.
6.143. Вкажіть сполуки, які утворюються при термічному розкладанні вольфраматної кислоти:
A) H2O;
B) W;
C) W2O3;
D) W2O3;
E) WO3.
6.144. Вкажіть продукт хімічної реакції: K2Cr2O7 + KOH®…:
A) K3[Cr(OH)6];
B) Cr(OH)3;
C) Cr2O3;
D) CrO3;
E) K2CrO4;
6.145. Вкажіть продукти хімічної реакції: 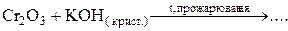 :
:
A) H2O;
B) K[Cr(OH)4];
C) K2Cr2O7;
D) K2CrO4;
E) KCrO2.
6.146. Вкажіть продукти хімічної реакції: 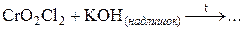 :
:
A) Cr(OH)3;
B) H2O;
C) K2Cr2O7;
D) K2CrO4;
E) KCl.
6.147. Вкажіть сполуку, яка при взаємодії з K2Cr2O7 при 0° призводить до утворення K2[Cr2O2(O2)5]:
A) Cr2O3;
B) H2O2;
C) H2SO4;
D) Na2O;
E) O2.
6.148. Вкажіть продукт, що утворюється при відновленні калій дихромату натрій тіосульфатом в кислому середовищі:
A) [Cr(OH)6]3-;
B) Cr(OH)2;
C) Cr(OH)3;
D) Cr2O3;
E) Cr3 + .
6.149. Закінчіть рівняння реакції, розставте коефіцієнти:
____MoO42- + ____NH4 + + PO43- + _____ ® _______________ ¯ + ________
6.150. Закінчіть рівняння реакції, розставте коефіцієнти:
((NH4)3[PO4·12MoO3] + ___NaOH ® NaNH4HPO4 ______ + ___Na2___ + ____
6.151. Закінчіть рівняння реакції та розставте коефіцієнти:
FeWO4 + Na2CO3 + O2 ® ______ + Fe2O3 + _____
6.152. Закінчіть рівняння реакції, розставте коефіцієнти:
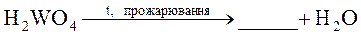
6.153. Закінчіть рівняння реакції, розставте коефіцієнти:
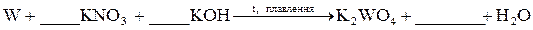
6.154. Закінчіть рівняння реакції, розставте коефіцієнти:
K2CrO4 + H2SO4® X + ______ + H2O;
X + H2SO4® 2K2Cr3___ + K2SO4 + H2O;
K2Cr3___ + H2SO4 ® _____¯ + _____ + H2O.
6.155. Закінчіть рівняння реакції, розставте коефіцієнти:
K2CrO4 + Pb(NO3)2 ® ________¯ + ______.
6.156. Розставте коефіцієнти в рівнянні реакції:
__NaCrO2 + ___PbO2 + ___NaOH + ___H2O ® ___Na2CrO4 + ___Na2[Pb(OH)4]
6.157. Закінчіть рівняння реакції, розставте коефіцієнти:
Cr2O3 + ____K2S2O7 ® Cr_________ + __K______.
6.158. Закінчіть рівняння реакції та розставте коефіцієнти:
K2Cr2O7 + ___(NH4)2S + KOH + ____® ____¯ + ____K3[Cr(OH)6] + ___
6.159. Закінчіть рівняння реакції та розставте коефіцієнти:
K2Cr2O7 + ___(NH4)2S + H2O ® Cr______¯ + _____¯ + ______ + 2KOH
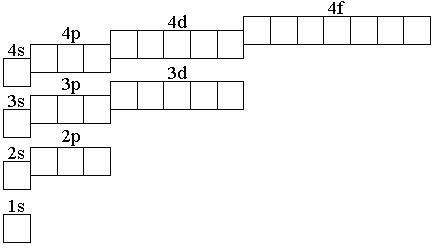
6.160. Позначте стрілками електрони в графічній схемі електронної будові атома Mn:
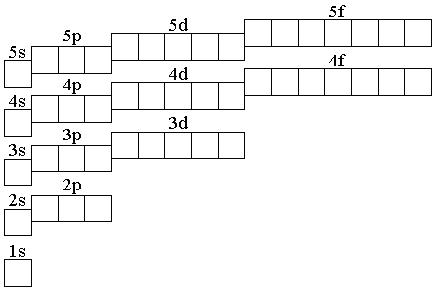
6.161. Позначте стрілками електрони в графічній схемі електронної будові атома Tc:
6.162. Вкажіть фізичні властивості манґану:
A) легкоплавкий;
B) м’який;
C) твердий;
D) тугоплавкий;
E) сріблясто – білий.
6.163. Вкажіть елемент з найбільшим радіусом атома:
A) Fe;
B) Co;
C) Tc;
D) Re;
E) Ru.
6.164. Вкажіть максимальну валентність Манґану:
A) 0;
B) 2;
C) 5;
D) 7;
E) 3.
6.165. Знайдіть відповідність між формулами сполук та кольором їх кристалів:
A) MnSO4; 1) зелений;
B) K2MnO4; 2) блідо – рожевий;
C) KMnO4; 3) темно – бурий;
D) MnO2. 4) темно – фіолетовий.
6.166. Вкажіть ступінь окиснення Манґану у KMnO4:
A) + 5;
B) + 3;
C) + 2;
D) + 6;
E) + 7.
6.167. Вкажіть максимальну ковалентність Mn, Tc, Re:
A) 6;
B) 7;
C) 8;
D) 9;
E) 10.
6.168. Зазначте сполуку, відновленням якої в промисловості одержують манґан:
A) Mn(OH)2;
B) KMnO4;
C) MnO;
D) MnO2;
E) Mn(NO3)2.
6.169. Встановіть відповідність між формулами та назвами сполук:
A) Mn(OН)2; 1) калій перманґанат;
B) KMnO4; 2) калій манґанат;
C) K2MnO4; 3) манґан (II) гідроксид;
D) K2MnO3. 4) калій манґаніт.
6.170. Вкажіть сполуку Манґану, яка проявляє амфотерні властивості:
A) MnO;
B) MnO2;
C) Mn(OН)2;
D) НMnO4;
E) Mn2O3.
6.171. Закінчіть рівняння реакцій, розставте коефіцієнти: MnO2+HCl →
6.172. Вкажіть рівняння реакцій, які використовуються для одержання манґану:
A) MnC2O4 →;
B) MnSO4 + H2O (електроліз) →;
C) C + MnO2 →;
D) MnO + Al →;
E) MnO →.
6.173. Вкажіть, які сполуки утворюються з сполук Манґану (II) під дією сильних окисників (наприклад, PbO2) у кислому середовищі:
A) Mn(I);
B) Mn(III);
C) Mn(IV);
D) Mn(V);
E) Mn(VII).
6.174. Вкажіть послідовність зменшення хімічної активності металів:
A) Re;
B) Mn;
C) K;
D) Ca;
E) Tc.
6.175. Визначте іон, хімічні властивості сполук якого подібні до сполук Mn2 + :
A) K + ;
B) Cu2 + ;
C) Fe2 + ;
D) Fe3 + ;
E) Pb2 + .
6.176. Вкажіть, стійкість якого ступеня окиснення збільшується при переході від Манґану до Ренію:
A) + 2;
B) + 7;
C) + 4;
D) + 3;
E) + 5.
6.177. Вкажіть рівняння реакцій, за якими можна одержати манґан (IV) оксид:
A) Mn(NO3)2 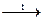 ;
;
B) Mn(OH)2 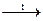 ;
;
C) H2MnO3 →;
D) KMnO4 + KI + H2O →;
E) KMnO4 + KI + H2SO4 →.
6.178. Вкажіть продукти реакції розкладу манґанатної кислоти у розчині:
A) H2O;
B) MnO;
C) HMnO4;
D) MnO2;
E) Mn(OH)4.
6.179. Вкажіть продукти реакції розкладу калій перманґанату:
A) MnO;
B) MnO2;
C) Mn2O3;
D) K2MnO3;
E) K2MnO4;
F) O2.
6.180. Вкажіть кислоти, з якими взаємодіють технецій і реній:
A) HCl;
B) H2SO4;
C) H2SO3;
D) HNO3;
E) CH3COOH.
6.181. Розташуйте сполуки за підвищенням їх окисних властивостей
KMnO4 (1), KTcO4 (2), KReO4 (3):
A) 1,2,3;
B) 2,1,3;
C) 3,1,2;
D) 3,2,1;
E) 1,3,2.
6.182. Вкажіть як послаблюється хімічна активність металів Mn(I), Tc(2), Re(3):
A) 3, 2, 1;
B) 2, 3, 1;
C) 1, 2, 3;
D) 2, 1, 3;
E) 1, 3, 2.
6.183. Закінчіть рівняння реакції, розставте коефіцієнти:
K2MnO4 + H2SO4 →
6.184. Закінчіть рівняння реакції, розставте коефіцієнти:
KMnO4 + KNO2 + H2O →
6.185. Закінчіть рівняння реакції, розставте коефіцієнти:
KMnO4 + H3PO3 + H2SO4 →
6.186. Закінчіть рівняння реакції, розставте коефіцієнти:
MnSO4 + (NH4)2S2O8 + H2O →
6.187. Закінчіть рівняння реакції, розставте коефіцієнти:
KReO4 + KI + HCl →
6.188. Закінчіть рівняння реакції, розставте коефіцієнти:
Tc2S7 + HNO3 →
6.189. Вкажіть електронну конфігурацію зовнішнього рівня атома Феруму:
A) 4s23d6;
B) 4s23d7;
C) 4s23d8;
D) 3d6;
E) 4s23d5.
6.190. Вкажіть серед наведених мінералів формулу залізної окалини:
A) Fe3O4;
B) Fe2O3;
C) FeO(OH);
D) FeO·Cr2O3;
E) Fe(OH)3.
6.191. Вкажіть серед наведених мінералів формулу бурого залізняка:
A) Fe(OH)3;
B) Fe3O4;
|
|
Дата добавления: 2014-11-29; Просмотров: 453; Нарушение авторских прав?; Мы поможем в написании вашей работы!