
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальна формула: СпН2п+1ОН, або R - ОН
Насичені одноатомні спирти
(алканоли, алкоголі)
Органічні сполуки, що містять одну функціональну гідроксильну групу - ОН.
Гомологічний ряд: СН3ОН метиловий (метанол)
Номенклатура: С2Н5ОН етиловий (етанол)
С3Н7ОН пропіловий (пропанол)
Спирти - похідні вуглеводнів, у молекулах яких один або кілька атомів водню заміщені гідроксильними групами (OH). Гідроксильну групу зв'язану з sp3-гібридизованим атомом вуглецю (карбону) називають спиртовою. Органічні сполуки з двома гідроксильними групами називаються діолами, з трьома -триолами і т.д. В українській мові їх також називають багатоатомними спиртами.

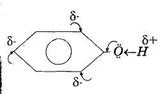
| Будова фенолу ОН- група, - зв'язана з ароматичним радикалом (феніл). 7і-система бензольного кільця втягує неподілені електрони Оксигену. Це приводить до збільшення полярності зв'язку О ← Н, за рахунок чого фенол набуває властивості слабкої кислоти (карболової). Також у бензольному ядрі підвищується електронна густина у положеннях 2,4,6, де і відбувається заміщення атомів Гідрогену. |
В органічній хімії, феноли — клас хімічних сполук, у молекулах яких присутня гідроксильна група (-OH), приєднана до ароматичної групи. Найпростішим з класу є фенол (C6H5OH).
По числу ОН-груп розрізняють:
одноатомні феноли: фенол (C6H5OH)
двоатомні феноли: (гідрохінон, пірокатехін, резорцин) і т. д.
Феноли мають слабкокислотні властивості, зокрема утворюють солеподібні продукти — феноляти.
Феноли виділяють з кам'яновугільної смоли, синтезують гідролізом відповідних галогенопохідних та інш. способами.
Застосування фенолів
Застосовують феноли у виробництві синтетичних смол, поліамідів та інш. полімерів, лікарських препаратів, барвників, поверхнево-активних речовин, антиоксидантів.
4.6.2 Альдегіди
Альдегіди (рос. альдегиды; англ. aldehydes; нім. Aldehyde), аліфатичні та ароматичні органічні хімічні сполуки, що містять альдегідну групу НС=О Назва утворена від алкоголю дегідратацій, тобто алкоголю, з якого вилучений водень. Аліфатичні альдегіди — це зазвичай рідини, наприклад, метаналь (формальдегід), етаналь (ацетальдегід). Ароматичні представники цього класу можуть бути як рідкими (бензальдегід), так і твердими (ванілін).
Для всіх альдегідів, крім формальдегіду, дві протилежні сторони карбонільної групи прохіральні енантіотопні. Здатні утворювати гідратну форму RCH(OH)2, особливо якщо група R — сильний електроноакцептор. Легко окиснюються до кислот. При відновленні дають спирти. Приєднують нуклеофіли, утворюючи ціангідрини або оксинітрили RHC(OH)CN, ацеталі RHC(OH)OAlk, з воденьвмісними нуклеофілами реакція йде далі (з утворенням азометинів, енамінів, оксимів, гідразонів, нітронів). Реакції також перебігають за участю атома Н-альдегідної групи (бензоїнова, формоїнова конденсації), альдегіди здатні приєднуватися до олефінів (реакція Прінса) та ін.
4.6.3 Карбонові кислоти
Карбонові кислоти (рос. карбоновые кислоты, англ. carboxylic acids, нім. Karbonsäuren f pl) – органічні сполуки, що містять одну або декілька карбоксильних груп СООН. За кількістю цих груп розрізняють одноосновні (бензойна, оцтова кислота), двоосновні (щавелева, фталева) та багатоосновні (лимонна) К.к.
До складу К.к. можуть входити також інші функціональні групи, напр., -ОН, -NH2, C=O. К.к. значно слабкіші за мінеральні кислоти. Ароматичні карбонові кислоти сильніші за насичені аліфатичні. Утворюють солі та різні похідні речовини: галогенангідриди, аміди, складні ефіри. Мають різноманітне промислове застосування і велике біологічне значення.
У молекулах карбонових кислот, як і в молекулах спиртів, містяться гідроксильні групи, унаслідок чого кислоти виявляють деяку схожість із спиртами. Але в кислотах гідроксильна група знаходиться під впливом групи атомів карбоксилу, в той час як в спиртах на неї впливає вуглеводневий радикал. Вплив карбонільної групи на гідроксил проявляється, зокрема, в тому, що атом водню гідроксильної групи в кислотах значно більш «кислотний», ніж у спиртах: легше заміщується металом і може відщеплюватися у вигляді катіона, наприклад:
СН3СООН ↔ СН3СОО + Н+
З лугом ці кислоти утворюють солі:
СН3СООН + NaOH = СН3COONa + Н2О
Карбонові кислоти є слабкими кислотами, тому їх солі зазнають гідролізу. Залежно від числа карбоксильних груп в молекулі, карбонові кислоти підрозділяються на одноосновні, двоосновні і т.д.
Похідні карбонових або мінеральних кислот, в яких атом водню в гідроксильній (ОН) групі заміщено на органічний радикал (R').
Назва естер походить від німецького слова Essig-Aether, етилацетат.
В українській мові вживалась в 30-ті роки минулого століття, та згодом була замінена на складний ефір.
За своєю будовою естери на перший погляд схожі з солями. Насправді ж схожість тут лише формальна. Зв’язок між вуглеводневим радикалом, тобто залишком, який виходить, якщо відняти від молекули вуглеводню один атом водню, і рештою частини молекули в естері ковалентний, а не іонний, як у солях.
4.6.4 Естери
Естери (складні етери), на відміну від більшості солей, нерозчинні у воді, але розчиняються в органічних розчинниках. Розчини їх не проводять електричного струму.
Реакція утворення естеру із спирту і кислоти є оборотною: пряма реакція називається естерифікацією, а зворотна – омиленням естеру.
Номенклатура складних ефірів
Назва складається таким чином: спочатку вказується група R', приєднана до кислоти, потім — назва кислоти із суфіксом ат. Наприклад, етилацетат (як в назвах неорганічних солей, наприклад, карбонат натрію).
Складні ефіри зазвичай розглядають як продукт реакції кислоти зі спиртом, наприклад, етилацетат можна сприймати як результат взаємодії оцтової кислоти і етанола. Досить часто вживають тривіальну назву складних ефірів. Етилацетат за нею можна назвати етиловим ефіром оцтової кислоти.
Так само називають складні ефіри мінеральних кислот. Диметиловий складний ефір сірчаної кислоти — диметилсульфат.
4.6.5 Жири
Жири — органічні речовини, які є сполукою складних ефірів трьохатомного спирту (гліцерину) і жирних кислот. У хімії називаютьсятригліцеридами.
Це повні складні ефіри трьохатомного спирту гліцерину СН2ОН — СНОН — СН2ОН і різноманітних жирних кислот. Серед них можуть бути як:
насичені кислоти, наприклад пальмітинова С15Н31СООН і стеаринова С17Н35СООН,так і: ненасичені кислоти (у тому разі з одним подвійним зв'язком - наприклад олеїнова кислота С17Н33СООН); з двома - лінолева кислота і з трьомаліноленова кислота подвійними зв'язками, а також з потрійним зв'язком, наприклад тариринова кислота С17Н31СООН), або навіть чотири (як у арахідонової кислоти) подвійні зв'язки між атомами вуглецю, - і трапляються лише в рослинних жирах і так званому риб'ячому жирі, в організмі людини не синтезуються, але потрібні для багатьох біохімічних процесів, і тому їх відносять до незамінних продуктів живлення. Суміш ненасичених жирних кислот називають вітаміном F[1].
Жирно-кислотний спектр жирів різноманітний. У рослинному й тваринному світі налічується близько 1300 видів жирів, але елементний склад їх відносно мало коливається й дорівнює в середньому,%:
С — 76 — 79, Н — 11 — 13 і О — 10 — 12.
Жири тваринного походження мають при кімнатній температурі, як правило, тверду консистенцію, риб'ячий жир та більшість рослинних жирів - рідку. З рослинних жирів твердими є масло какао та пальмове масло.
Шляхом гідролізу (омилення) жири легко розщеплюються на гліцерин і жирні кислоти, причому різні кислоти проявляють неоднакову стійкість до дії високих температур і мікроорганізмів. Так, насичені жирні кислоти досить стійкі не тільки при звичайних температурах, але й при нагріванні навіть до 400 °C вони важко втрачають свою карбоксильну групу й не розкладаються.
Досить стійкими є й ненасичені жирні кислоти з одним подвійним зв'язком (типу олеїнової).
Ненасичені кислоти із двома й більшим числом подвійних зв'язків менш стійкі; вони окислюються, твердіють, стають темними, набирають неприємного запаху. На це потрібно звертати увагу при використанні їх. Вони легко окисляються й полімеризуються, а при нагріванні до 300 °C розпадаються з розривом вуглецевого ланцюга й утворенням суміші насичених і ненасичених вуглеводнів жирного ряду.
Для хімічної характеристики жирів й інших ліпідів визначаються температура плавлення й числа — йодне, омилення й кислотності.
4.6.6 Вуглеводи
Вуглеводи — органічні сполуки з емпіричною формулою Cm(H2O)n, до складу яких входять тільки Вуглець, Кисень та Водень. Вуглеводи є складовою частиною клітин усіх живих організмів.
Вуглеводи є найпоширенішими органічними сполуками, що підтверджується тим фактом, що більше половини органічного вуглецю на Землі існує у формі вуглеводів.
Здебільшого вуглеводи є сполуками рослинного походження — це продукти фотосинтезу і таким чином вони є базовою ланкою у трансформації сонячної енергії у хімічну для забезпечення життя на Землі.
Поряд з білками і жирами, вуглеводи — важлива складова частина харчування людини і тварин, багато з них використовується як технічна продукція.
З хімічної точки зору це є полігідроксикарбонільні сполуки та їхні похідні із загальною формулою СnH2nOn.
Низькомолекулярні вуглеводи відомі також як цукри.
Найвідомішими представниками вуглеводів є целюлоза, крохмаль,
Контрольні запитання:
1. Як змінюються кислотно-основні властивості спиртів?
2. Як можна спирти перетворити на етиленові вуглеводні?
3. Дегідратація спиртів.
4. Будова молекули фенолу.
5. Як пояснити взаємний вплив груп атомів в молекулі фенолу?
6.Чим зумовлена висока реакційна здатність алдегідів і кетонів?
7. Яка реакція є якісною пеакцією на альдегіди?
8. Від чого залежать хімічні властивості карбонових кислот?
9. Як змінюються кислотні властивості карбонових кислот?
10 Специфічні властивості мурашиної кислоти?
Лекція 16 (Заняття 23)
Тема 4.7 Нітрогеновмсні органічні сполуки: аміни, амінокислоти, білки.
План:
4.7.1 Амі́ни
4.7.2 Амінокислоти
4.7.3 Білки́
4.7.1 Амі́ни
Амі́ни — азотовмісні органічні хімічні сполуки, похідні амоніаку (NH3), в якому атоми гідрогену заміщені однією чи багатьма групами інших атомів — вуглеводневими радикалами.
Якщо амін створений заміщенням одного атома гідрогену в NH3, він називається первинним аміном (формула RNH2), якщо двох — вторинним аміном(R2NH), а якщо трьох — третинним аміном (R3N). Четвертинні аміни мають чотири замісники при атомі нітрогену, внаслідок чого атом нітрогену в цих амінах має електричний заряд +1.
Залежно від природи радикалів аміни називаються: аліфатичними, ароматичними та гетероциклічними. Нижчі аліфатичні аміни — гази, вищі — рідиний тверді речовини. Найважливішим ароматичним аміном є анілін.
Аміни проявляють основи властивості через наявність у атома нітрогену неподіленої електронної пари. Однією з важливих реакцій аліфатичних амінів є взаємодія їх з HNO2: первинні аміни при цьому утворюють спирти, вторинні — нітрозаміни, третинні не реагують. Ароматичні первинні аміни з HNO2 утворюють діазосполуки.
Аміни широко використовуються в анілофарбувальній та хімічно-фармацевтичній промисловості, наприклад, як складники реагентів при флотації та масляній агломерації (грануляції,флокуляції) вугілля.
4.7.2 Амінокислоти
Амінокислота — це азотовмісна карбонова кислота, тобто — це хімічна речовина, молекула якої одночасно містить аміногрупу –NH2 (в деяких випадках — іміногрупу =NH) та карбоксильну групу –СООН, і вуглецевий скелет. За тим, до якого атому вуглецю приєднана аміно- (або іміно-) група, амінокислоти поділяються на α, β, γ і т. д При цьому α-амінокислотами називаються такі, в яких карбоксильна та аміногрупа приєднані до одного і того ж атому вуглецю; β-амінокислотами — такі, де аміногрупа приєднана до атому вуглецю, сусіднього з тим, до якого приєднана карбоксильна; γ-амінокислотами — такі, де аміногрупа приєднана через один атом вуглецю від карбоксильної, і так далі.
Залишок амінокислоти — це те, що лишається від амінокислот при втраті ними молекули води в ході формування пептидного зв’язку (коли аміногрупа втрачає іон Н+, а карбоксильна — іон ОН-).
Амінокислоти є структурними одиницями, з яких побудовані протеїни (білки). Завдяки пептидним зв’язкам вони формують полімерні ланцюги, що називаються поліпептидами (якщо вони відносно короткі), або повноцінні білкові молекули.
До складу протеїнів входять 20 α-амінокислот, які кодуються генетичним кодом і називаються протеїногенними або стандартними амінокислотами. Окрім них в організмі продукуються і інші амінокислоти, що називаються непротеїногенними або нестандартними. Одна із стандартних амінокислот, пролін, має вторинну аміногрупу (=NH замість –NH2), яка також часто називається іміногрупою.
Щонайменше ще дві амінокислоти, окрім двадцяти «стандартних», зрідка можуть бути долучені до формування протеїнів:
Селеноцистеїн, що входить до деяких нечисленних протеїнів і кодується в цих випадках кодоном UGA, який звичайно означає кінець синтезу;
Піролізин, що використовується деякими метаногенними бактеріями при виробленні метану. Також, як і селеноцистеїн, кодується стоп-кодоном цих організмів, але в даному випадку це кодон UAG.
Незважаючи на те, що генетичним кодом живих істот кодуються лише 20 амінокислот, в природі їх знайдено близько ста. Деякі з амінокислот також знайдені і в метеоритах, особливо в тих, що називаються карбоген-хондритами. Бактерії та рослини можуть виробляти досить незвичайні амінокислоти, котрі можуть долучатись до складу пептидних антибіотиків (нізин, аламетицин);лантіонін — зв’язаний дисульфідним хімічним зв’язком димер аланіну — спільно з ненасиченими амінокислотами входить до складу лантибіотиків (пептидні антибіотики бактеріального походження). 1-аміноциклопропан-1-карбоксильна кислота (АСС) — невелика за молекулярною масою широко розповсюджена циклічна амінокислота, що виступає проміжним продуктом в синтезі рослинного гормону етилену.
На додаток до синтезу протеїнів, амінокислоти в тваринному організмі виконують багато інших важливих біологічних функцій. Гліцин та глутамат (аніон глутамінової кислоти), окрім входження до складу протеїнів, використовуються також як нейромедіатори при нервовій передачі через хімічні синапси. Велика кількість амінокислот є проміжними продуктами при синтезі інших важливих речовин: так, триптофан є прекурсором нейромедіатору серотоніну, а гліцин є одним з реагентів в синтезі порфірінів (таких як дихальний пігмент гем). Також біологічно важливими є і нестандартні амінокислоти: ГАМК (ще один нейромедіатор), карнітин (використовується для транспорту ліпідів в клітині), орнітин, цитрулін, гомоцистеїн, гідроксипролін, гідроксилізин,саркозин і т. ін.
Деякі з 20-ти прjтеїногенних амінокислот називаються «незамінними» — це такі, що не виробляються в організмі і повинні надходити з їжею. Для людини це лізин, лейцин, ізолейцин, метіонін,фенілаланін, треонін, триптофан, валін, а для дітей також гістидин та аргінін.
4.7.3 Білки́
Білки́ — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. В однині (білок) термін найчастіше використовується для посилання на білок, як речовину, коли не важливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на деяку кількість білків, коли точний склад важливий.
Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами. Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрованагенетичним кодом. Хоча генетичний код більшості організмів визначає лише 20 «стандартних» амінокислот, їхнє комбінування уможливлює створення великого різномаїття білків із різними властивостями. Крім того, амінокислоти у складі білка часто піддаються посттрансляційним модифікаціям, які можуть виникати і до того, як білок починає виконувати свою функцію, і під час його «роботи» в клітині. Для досягнення певної функції білки можуть діяти спільно, і часто зв'язуються, формуючи великі стабілізовані комплекси (наприклад, фотосинтетичний комплекс).
Функції білків в клітині різноманітніші, ніж функції інших біополімерів — полісахаридів і нуклеїнових кислот. Так, білки-ферменти каталізуютьпротікання біохімічних реакцій і грають важливу роль в обміні речовин. Деякі білки виконують структурну або механічну функцію, утворюючицитоскелет, що є важливим засобом підтримки форми клітин. Також білки грають важливу роль в сигнальних системах клітин, клітинній адгезії,імунній відповіді і клітинному циклі.
Білки — важлива частина харчування тварин і людини, оскільки ці організми не можуть синтезувати повний набір амінокислот і повинні отримувати частину з них із білковою їжею. У процесі травлення протелітичні ферменти руйнують спожиті білки, розкладаючи їх до рівня амінокислот, які використовуються при біосинтезі білків організму або піддаються подальшому розпаду для отримання енергії.
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец. πρώτα — «першорядної важливості». Проте, їхня центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком. Секвенування першого білка — інсуліну, тобто визначення його амінокислотної послідовності, принесло Фредерику СенгеруНобелівську премію з хімії 1958 року. Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу, за що автори методу, Макс Перуці Джон Кендрю, отримали Нобелівську премію з хімії 1962 року
Контрольны запитання:
1. Як доказати амфотерність амінів?
2. Як відбувається реакція внутрішньої нейтралізації?
3. Як змінюються кислотно - основні властивості в ряду амінів?
4. Якою реакцією можна розпізнавати первинні, вторинні й третинні аліфатичні аміни?
5. Як можна пояснити взаємний вплив груп атомів в молекулі аніліну?
Лекція 17 (заняття 26)
Тема 5.1 Органічні речовини як основа сучасних матеріалів: пластмаси, синтетичні каучуки, гума.
План:
5.1.1 Полімерні матеріали (пластмаси)
5.1.2 Наповнювачі
5.1.3 Синтетичні каучуки
5.1.4 Гу́ма
5.1.1 Полімерні матеріали (пластмаси)
Пласти́чна ма́са (пластмаса) — штучно створені матеріали на основі синтетичних або природних полімерів. Пластмаси формують при підвищеній температурі, у той час коли вони мають високу пластичність. Сировиною для отримання полімерів є нафта, природний газ, кам'яне вугілля, сланці.
Поширенню пластмас сприяють їх мала густина, що значно зменшує масу деталей, висока корозійна стійкість, широкий діапазон властивостей. Добрі антифрикційні характеристики багатьох пластмас дають можливість з успіхом застосовувати їх для виготовлення підшипників ковзання. Високий коефіцієнт тертя деяких пластмас дозволяє використовувати їх для гальмових пристроїв. Певні пластмаси мають специфічні властивості: високі електроізоляційні характеристики, велику прозорість та ін.
Важливою перевагою пластмас є можливість їх переробки у вироби найбільш продуктивними способами з коефіцієнтом використання матеріалу 0,9-0,95 — литтям, видавлюванням тощо.
Водночас пластмасам притаманні і деякі недоліки: невисокі міцність, твердість і жорсткість, велика повзучість, особливо у термопластів, низька теплостійкість(більшість пластмас має робочу температуру не вищу, ніж 200 °C, і лише деякі можуть працювати при 300—400 °С), низька теплопровідність (в 500—600 разів менша, ніж у металів), здатність старіти (втрачати властивості під впливом тепла, світла, води та інших факторів).
При старінні зменшується еластичність і міцність пластмас, збільшується їх жорсткість і крихкість. Під еластичністю розуміють здатність матеріалу до великих зворотних деформацій. Цей термін за фізичним сенсом аналогічний пружності, але перший вживається для аморфних, а другий — для кристалічних тіл.
Більшість полімерів перебуває в аморфному (склоподібному) стані. Такі полімери називають смолами. В пластмасах може бути присутньою певна кількість кристалічної фази, яка підвищує міцність, жорсткість і теплостійкість полімера. У виробництві пластмас використовують в основному синтетичні смоли.
Крім полімерів пластмаси можуть містити наповнювачі, пластифікатори та спеціальні добавки, що надають пластмасі певних властивостей.
5.1.2 Наповнювачі
Наповнювачами (зміцнювальними компонентами) можуть бути органічні або неорганічні речовини у вигляді порошків (графіт, деревне або кварцове борошно), волокон (паперових, бавовняних, азбестових, скляних) або листів (тканина, папір, деревний шпон). Наповнювачі підвищують міцність, зносостійкість, теплостійкість та інші властивості пластмас. Їх частка у пластмасі може досягати 40-80%.
Пластифікаторами вводять для підвищення пластичності та еластичності пластмас (гліцерин, касторове або парафінове масло).
Добавками можуть бути:
стабілізатори — речовини, які уповільнюють старіння (сажа, сірчані сполуки, феноли);
мастильні матеріали — речовини, що усувають прилипання матеріалу до прес-форми, збільшують його текучість, зменшують тертя між частинками композиції (віск, стеарин, олеїнова кислота);
барвники — речовини, що надають пластмасовим виробам декоративного вигляду (охра та ін.);
каталізатори — речовини, що прискорюють твердіння пластмаси (уротропін, оксиди металів);
антипірени — речовини, які зменшують горючість полімерів (наприклад, сполуки сурми);
антистатики — речовини, які перешкоджають виникненню і накопиченню статичного електричного заряду у виробах з полімерних матеріалів;
пороутворювачі — речовини, які розпадаються під час нагрівання, виділяючи гази, що спінюють смолу, внаслідок чого утворюється поро- та пінопласти з пористою структурою.
5.1.3 Синтетичні каучуки
Синтетичний каучук - вихідною речовиною для одержання штучного каучуку за способом С. В. Лебедєва служить ненасичений вуглеводень з двома подвійними зв'язками бутадієн(дивініл) CH2=CH—CH=CH2.
Процес полімеризації проводять в присутності металічного натрію як каталізатора під тиском:
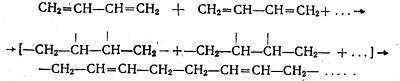
Скорочено будову молекули бутадієнового каучуку виражають формулою:
(—СН2—СН=СН—СН2—)n
Бутадієновий каучук, як видно з формули, являє собою ненасичену сполуку. Його молекули мають лінійну структуру. Однак молекули каучуку не витягнуті, а звивисті. Цим обумовлюється його здатність розтягуватися.
Вулканізація каучуку
Сирий каучук має низьку міцність і дуже липкий, особливо при нагріванні, а на морозі стає твердим і ламким. Тому для виготовлення різних виробів у сирому вигляді каучук непридатний. Свої цінні властивості каучук набуває при вулканізації, тобто при нагріванні з сіркою. Вулканізований каучук називають гумою.
При процесі вулканізації з каучуку, сірки і наповнювача (переважно сажі) виготовляють суміш, якою наповнюють відповідні форми і під тиском нагрівають. При 130—160°С каучук взаємодіє з сіркою і молекули його зв'язуються між собою атомами сірки. Частково вони зв'язуються між собою і безпосередньо. Зв'язок між ними здійснюється за рахунок вільних валентностей, які виникають при розриві подвійних зв'язків. Процес вулканізації бутадієнового каучуку схематично можна представити такими рівняннями:
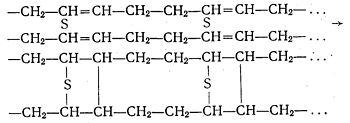
Вміст сірки у вулканізованому каучуку становить 1—3%. Вулканізований каучук значно більш еластичний і міцний, ніж сирий. Сирий каучук розчиняється в органічних розчинниках, зокрема в бензині (каучуковий клей), а вулканізований не розчиняється, а лише набухає.
В 1927 році німецький хімік Вальтер Бок (Walter Bock) в Ліверкузені синтезував стиролбутадієновий каучук. У 1932 р. Радянський Союз організував промислове виробництво бутадієнового синтетичного каучуку за способом С. В. Лебедєва. Тепер виробляються й інші види синтетичних каучуків, які за своїми властивостями значно кращі від природного каучуку.
5.1.4 Гу́ма
Гу́ма — матеріал, необхідний для виробництва різноманітних виробів - від автомобільних шин до хірургічних рукавичок. Головна перевага гуми - її еластичність. Вона може розтягуватися й гнутися, а потім приймати початкову форму. Гума може бути як і м’яка, так і тверда. Натуральну гуму виробляють з особливої рідини - латексу, який одержують із соку каучукового дерева. Батьківщина каучукового дерева - Центральна таПівденна Америка. Сьогодні його вирощують на плантаціях у теплих країнах по усьому світу, зокрема й у Південно-Східній Азії. Після Другої світової війни з нафти хімічним шляхом одержали синтетичну гуму, яка набула широкого застосування. Зараз частка синтетичної гуми складає дві третини світового виробництва гуми.
Процес виробництва
Для виготовлення гуми каучук слід переробити, додавши до нього сірку. Цей процес називають вулканізацією. Одержаний матеріал є міцнішим та еластичнішим за каучук-сирець. Для більшої тривкості до гуми додають тканини або металеві дроти (у виробництві автомобільних шин).
Призначення
Понад половину виробленої гуми витрачають на автомобільні шини. Крім шин, із гуми виробляють взуття, одяг, рукавички, труби, ластики,тенісні м'ячі, прокладки клапанів для герметизації трубопроводів і двигунів.
Компоненти гуми
Найважливішим компонентом гуми є натуральний або синтетичний каучук, від якого залежать основні властивості гумового матеріалу. Для поліпшення властивостей гуми до її складу крім каучуку додають вулканізатори, зміцнювачі, пластифікатори, барвники, стабілізатори та інші компоненти.
Вулканізатори (сірка, селен, іноді пероксиди) додаються в кількістю 1-5 %. Внаслідок певних хімічних реакцій вулканізатора з каучуком утворюється високоеластична гума. Якщо масову частку сірки в сирій гумі довести до 30 і більше %, то утворюється твердий нееластичний матеріал ебоніт, який використовують як ізолятор в електротехніці. Вулканізацію можна активізувати оксидами магнію, свинцю, цинку та ін.
Зміцнювані — дрібнодисперсні порошки сажі, оксиду кремнію або оксиду цинку — додають для підвищення міцності, твердості і стійкості гумових виробів. Для відповідальних гумових виробів (шини, шланги високого тиску, привідні паси та ін.) використовують волоконні зміцнювані із синтетичних волокон або металевого дроту, покритого латунню, щоб підвищити зчеплення дроту з полімером.
Пластифікатори (тіарафін, каніфоль, стеаринова кислота, рослинні олії) сприяють рівномірному розподілу компонентів у суміші, полегшують формування виробів та підвищують їхморозостійкість.
Барвники (мінеральні й органічні) надають гумовим виробам бажаного кольору.
Сукупність технічних властивостей гумових матеріалів дає змогу застосовувати їх для амортизації та демпфірування, хімічного захисту деталей машин, трубопроводів, шлангів, ущільнення і герметизації в умовах повітряних і рідких середовищ, для покришок і камер коліс літаків та автотранспорту тощо. Номенклатура гумових виробів налічує понад 40000 найменувань.
За призначенням у машинобудуванні гумові деталі поділяють на такі групи: ущільнювачі, вібро- та звукоізолятори, протиударні, силові (шестірні, корпуси насосів, муфти, шарніри), антифрикційні, фрикційні деталі та інструменти. Гума також використовується з метою захисну виробів та як декоративна речовина.
Контрольні запитання:
1. Що називається полімером?
2. Що називається мономером?
3. Написати реакцію утворення полімеру
4. Здійснити перетворення:
СРС
Тема 5.2 Штучні й синтетичні волокна.
План:
5.2.1 Поняття про штучні волокна
5.2.2 Добування штучних волокон
5.2.3 Поняття про синтетичні волокна на прикладі капрону
5.2.1 Поняття про штучні волокна
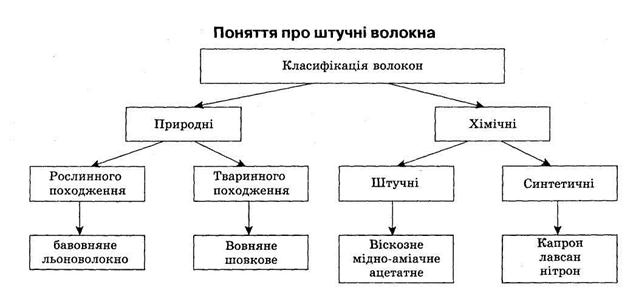
5.2.2 Добування штучних волокон
Вихідним полімером для добування штучних волокон беруть целюлозу деревини або бавовняний пух, що залишився на насінні, після того, як з нього зняли волокна. Така целюлоза має невпорядковану структуру. Для того, щоб лінійні молекули полімера впорядкувати вздовж осі волокна, треба зробити їх рухомими. Це можливо лише під час розчинення целюлози, оскільки під час розплавлення вона розкладається. Користуються різними розчинниками целюлози, і тому існує три способи добування штучного волокна.
1. Основний спосіб - ацетатний. Целюлозу обробляють оцтовим альдегідом в присутності Н2SO4. Добутий ацетат розчиняють у суміші дихлоретану і етанолу. Утворюється в'язкий розчин, який крізь тонкі отвори (фільєри) продавлюють в гарячу суху камеру; розчинник випаровується, а ацетат целюлози утворює нитки.
Ацетатний шовк міцний, м'який, менше зсідається під час прання. Але гірше вбирає вологу, тому поступається природному волокну за гігієнічними якостями.
2. Віскозний спосіб - целюлозу обробляють спочатку NаОН, а потім СS2 і добувають віскозу (лужний розчин ксантогенату целюлози). Віскозу пропускають крізь фільєри у розчин H2SO4 або NаНSO4, де ксантогенат гідролізує з утворенням целюлози у вигляді волокон.
3. Мідно-аміачний спосіб - целюлозу розчиняють у реактиві Швейцера (розчин Си(ОН)2 у NH3) і розчин пропускають крізь фільєри у теплу воду зі слабкою Н2SO4. При цьому мідно-аміачна сполука целюлози гідролізує з утворенням целюлози у вигляді волокон.
З хімічної точки зору, ацетатний шовк відрізняється від віскозного та мідно-аміачного тим, що він є складним ефіром целюлози, тоді як інші види шовку є вільною целюлозою.
Найдорожчий - ацетатний шовк. Найдешевший - віскозний шовк.
Поняття про синтетичні волокна на прикладі капрону
Капрон - це поліамідне волокно.

|
|
Дата добавления: 2014-11-29; Просмотров: 2839; Нарушение авторских прав?; Мы поможем в написании вашей работы!