
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поверхностная энергия, поверхностное натяжение. Адсорбция
|
|
|
|
Поверхностно-активные вещества (ПАВ)
Вещества, концентрирующиеся (адсорбирующиеся) на поверхности раздела фаз и вызывающие понижение поверхностного натяжения, называют поверхностно-активными веществами (ПАВ).
Обычно ПАВ - это органические соединения, молекулы которых имеют как гидрофильные полярные группы (-ОН; -СООН; -NH2; -SH; -GN; -N02; SO3H и др.), так и гидрофобные неполярные группы (углеводородные, содержащие 10-18 атомов углерода, кремнийорганические и т.д.).
Дифильность молекулы поверхностно-активного вещества принято изображать так:
 |
Рисунок 1 – Строение дифильных молекул ПАВ
где кружок обозначает полярную (гидрофильную) часть, а черточка - неполярную (гидрофобную) часть молекулы ПАВ.
Молекулы ПАВ адсорбируются на границе раздела фаз так, что гидрофильные группы «смотрят в воду» - в сторону полярной фазы. Напротив, неполярный гидрофобный радикал стремится как бы «вытеснить» молекулу ПАВ из воды, ориентируя её в сторону неполярной углеводородной или газовой (воздух) среды.
На рис. 2 изображено расположение молекул ПАВ в поверхностном слое на границе воды с воздухом. Если концентрация ПАВ мала, то и в поверхностном слое молекул немного ( рис.2, а). При увеличении концентрации ПАВ, его молекулы располагаются перпендикулярно к поверхности воды, образуя сплошной слой (рис. 2, б).
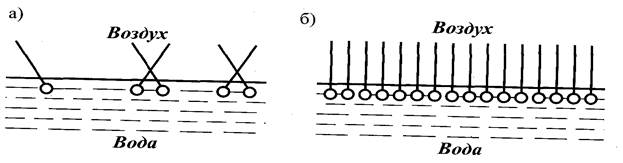
а) – прямая эмульсия, б) – обратная эмульсия
Рисунок 2 – Расположение молекул ПАВ в поверхностном слое
При адсорбции ПАВ на твёрдой поверхности наблюдается аналогичная, но обратная картина. Например, к неполярной поверхности парафина на границе с водой обращен неполярный углеводородный радикал молекулы ПАВ, а полярная группа ориентирована к воде.
|
|
|
При введении ПАВ в воду поверхностное натяжение уменьшается, снижается угол смачивания, т.е. смачивание поверхности улучшается.
Если ПАВ адсорбируются на поверхности твёрдого тела, то угол смачивания по отношению к воде возрастает и поверхность гидрофоби-зируется.
ПАВ широко используют в синтетических моющих средствах (CMC). Цель мытья и стирки - удаление с поверхности прилипших загрязнений: жира, пыли, грязи.
Для удаления жира с поверхности с помощью обычного мыла необходимо уменьшить поверхностное натяжение на границе раздела моющий раствор — загрязнение и моющий раствор - поверхность (рис. 3). В результате адсорбции на поверхности загрязнения молекулы мыла обращаются полярной группой в воду, а неполярной - к загрязнению и отмываемой поверхности, снижая поверхностное натяжение. Это способствует отделению частиц грязи от поверхности и препятствует их обратному оседанию на поверхности.

1 - мыльный раствор; 2 - загрязнение (жир); 3 - твёрдая поверхность;
4 - гидрофильный слой моющего вещества
Рисунок 3 - Схема отмывания загрязнения (жира) при стирке
При гидролизе солей, входящих в состав мыла, в воде также образуется щёлочь, разрушающая жиры. Моющее действие ПАВ обусловлено еще и тем, что в их присутствии образуются устойчивые пены.
Все ПАВ делят на две группы: ионогенные, которые диссоциируют в растворах на ионы, и неионогенные (не образующие ионов). Ионогенные ПАВ бывают анионные и катионные (анионные ПАВ образуют при диссоциации отрицательно заряженные, а катионные - положительные поверхностно-активные ионы).
ПАВ находят широкое применение в технологии строительных материалов: их вводят в малых количествах (0,05 - 0,3% от массы цемента) в бетонные и растворные смеси при их изготовлении. Добавки ПАВ пластифицируют бетонные и растворные смеси, снижают необходимое для затво-рения количество воды и расход цемента. Они также снижают пористость бетона, повышают его морозостойкость и водонепроницаемость.
|
|
|
Вода характеризуется большой величиной поверхностного натяжения: о = 72,75 мДж/м2 при 20°. Для большинства чистых жидкостей на границе с воздухом, насыщенным их парами, величина поверхностного натяжения находится в пределах 10-50 мДж/м2.
На рис.4 показано, как возникает поверхностное натяжение. На молекулу А, находящуюся в глубине жидкости (вода), со всех сторон равномерно действуют силы межмолекулярного притяжения (за счёт взаимодействия с другими молекулами Н20).

Рисунок 4 - Схема возникновения поверхностного натяжения
Эти же силы, действующие на молекулы поверхности (например Б), направлены внутрь жидкости. Поэтому поверхность жидкости оказывается в состоянии натяжения - она всё время стремится сократиться. Под воздействием поверхностного натяжения небольшие капли воды стремятся принять шарообразную форму, соответствующую наименьшей возможной величине поверхности.
Смачивание жидкостью твёрдой поверхности также является результатом действия сил поверхностного натяжения (рис. 5).
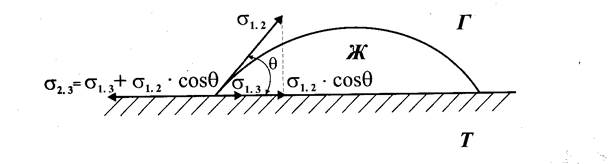
Рисунок 5 - Равновесие сил поверхностного натяжения на периметре
смачивания
Периметр капли воды на поверхности твёрдого вещества является границей трёх сред - жидкости (1), воздуха (2) и твёрдого тела (3). Поверхность жидкость - воздух имеет поверхностное натяжение — σ1.2, поверхность воздух - твёрдое тело - σ2.3и поверхность жидкость - твёрдое тело - σ1.3Угол между поверхностями жидкость - газ и твердое тело -жидкость называют краевым углом смачивания (θ).
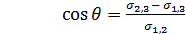 (1.1)
(1.1)
В зависимости от значений краевого угла различают:
1) θ< 90°, cos θ> 0 - смачивание поверхности жидкостью (например, водой);
2)θ> 90°, cos θ< 0 - смачивания поверхности не происходит;
3) краевой угол не устанавливается, и капля растекается в плёнку.
Если вода смачивает поверхность, то последнюю называют гидрофильной, если не смачивает, то поверхность называют гидрофобной. Вода, например, хорошо смачивает поверхности некоторых силикатов (в том числе, стекла). При этом она не смачивает поверхности твёрдых углеводородов - парафина, полиэтилена, тефлона, кремнийорганических полимеров и т.п.
|
|
|
При смачивании молекулы воды сильнее взаимодействуют с поверхностью твёрдого тела, чем с другими молекулами воды, поэтому вода приподнимается по стенке.
Так, в стеклянной трубке мениск вогнутый (рис.6, а). Если вода не смачивает поверхность, форма мениска выпуклая(рис.6, б).
За счёт кривизны поверхности под вогнутым мениском давление воды будет меньше. Это приводит к тому, что в случае вогнутого мениска вода поднимается до тех пор, пока гидростатическое давление не компенсирует разности давлений. В узкой трубочке вода (смачивающая жидкость) устанавливается выше уровня в широкой трубке. Известно, что высота поднятия жидкости (воды) в капиллярной трубке тем больше, чем выше поверхностное натяжение и чем меньше радиус трубки и плотность
жидкости.
Если твёрдый материал пронизан тонкими капиллярами и смачивается водой, то вода втягивается по капиллярам, причём на тем большую высоту, чем уже каналы.
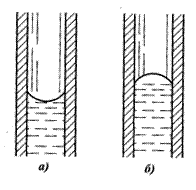
а) мениск вогнутый б) мениск выпуклый
Рисунок 6 - Формы менисков
Адсорбция - процесс, сопровождающийся тепловым эффектом. Различают интегральную теплоту адсорбции Q в кДж/кг адсорбента и дифференциальную теплоту адсорбции q в кДж/моль адсорбтива. Теплота физической адсорбции близка к теплоте фазовых переходов и составляет 1-20 кДж/моль. При хемосорбции тепловые эффекты могут составлять сотни килоджоулей на 1 моль в зависимости от характера протекающей химической реакции.
Хемосорбция - химический процесс, требующий значительной энергии активации, поэтому увеличение температурыспособствует хемосорбции.
Лэнгмюр создал и обосновал теорию мономолекулярной адсорбции газов на твердом адсорбенте, предположив,что активные центры равномерно распределены по поверхности и адсорбция локализована.
Уравнение изотермы мономолекулярной адсорбцииимеет вид
 (1.2)
(1.2)
где а - адсорбция, моль/м2; а∞- предельная адсорбция (емкость монослоя), моль/м2; k - константа адсорбционногоравновесия; р - равновесное давление адсорбтива в объемефазы, граничащей с адсорбентом.
|
|
|
При р→0 a = a ∞ kp; при р →∞ наступает насыщениеадсорбционного слоя и а =а ∞. Данное уравнение хорошовыражает адсорбцию на твердых поверхностях при небольших давлениях газа в окружающем пространстве, а такжеадсорбцию поверхностно-активных молекул из растворовпри небольших концентрациях (в этом случае вместо р пользуются величиной С).
По значению а ∞может быть определена важная характеристика твердого адсорбента - удельная активная поверхность Syд. Если известна So - площадь, занимаемая одноймолекулой газа или поверхностно-активного вещества в насыщенном монослое, то
Syx=a ∞ S0NA, (1.3)
где NA - постоянная Авогадро.
Процессы адсорбции паров вещества на твердых адсорбентах не всегда согласуются с изотермой Лэнгмюра. Взависимости от внешних условий, природы адсорбента иадсорбтива адсорбция может протекать с образованием наповерхности полимолекулярного адсорбционного слоя; изотерма тогда будет иметь более сложный вид.
Брунауэром, Эмметом и Тейлером (1935-1940) быласоздана теория полимолекулярной адсорбции паров натвердых, гладких и пористых адсорбентах (теория БЭТ).
Согласно этой теории на активных точках поверхности адсорбента при определенных условиях могут образовыватьсяконденсированием полимолекулярные слои. Количество адсорбированного вещества рассчитывается по уравнению
 (1.4)
(1.4)
где а ∞ - предельная мономолекулярная адсорбция на твердом адсорбенте; С - константа уравнения; р– равновесноедавление пара в окружающем пространстве при заданныхусловиях; ps - давление насыщенного пара при данной температуре.
При значениях p<<ps процесс адсорбции пара протекает как мономолекулярный и выражается уравнением
 (1.5)
(1.5)
В современных научных лабораториях широко применяется также метод БЭТ определения удельной активной поверхности адсорбента по низкотемпературной адсорбциипростых веществ (азот, аргон, криптон). Предельная адсорбция а ∞вычисляется графически по линейной форме
уравнения БЭТ:
 (1.6)
(1.6)
Зная а ∞ и приняв S0 для молекулы азота при низких температурах равным 16,5-1020 м2, можно вычислить SУД по уравнениюSуд = S0 Na a ∞.
В случае тонкопористых адсорбентов (радиус пор порядка 10-9 м) трудно говорить о правильном заполнении адсорбционных слоев, как при адсорбции на гладких поверхностях. Способность к адсорбции увеличивается с уменьшением радиуса пор; в местах сужения пор адсорбция будетповышена по сравнению с адсорбцией в более широкой части пор. Поэтому применение уравнения БЭТ для расчетаадсорбции мелкопористыми адсорбентами затруднено, аопределение удельной активной поверхности адсорбента Sуд по а∞, не всегда дает правильные результаты.
Явление адсорбции на границе с жидкой фазой описывается также теоретическим уравнением Гиббса. Адсорбциявещества на поверхности раздела фаз обозначается Г (вмоль/м2) и зависит от равновесной концентрации вещества врастворе (С). Уравнение Гиббса выражает распределениеадсорбированного вещества между фазой и поверхностью
раздела фаз:
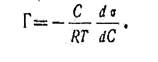 (1.7)
(1.7)
Величина  называется поверхностной активностью. Мерой поверхностной активности принято считатьпри С→0
называется поверхностной активностью. Мерой поверхностной активности принято считатьпри С→0
 (1.8)
(1.8)
Если вещество, адсорбируясь, понижает поверхностное натяжение данной границы раздела фаз, то оно поверхностно активно; поверхностная активность G > 0 и адсорбция Г > 0, т. е. происходит накопление молекул этого вещества на данной поверхности раздела. На границе раздела вода-воздух(пар) или вода-масло поверхностно активными веществами будут: органические кислоты, спирты, нитро- и сульфопроизводные,амины,белки, мыла и моющие вещества.
Если вещество при введении его в раствор повышает поверхностное натяжение данной поверхности раздела фаз,то это вещество поверхностно неактивно; поверхностная активность G < 0 и адсорбция Г< 0. На границе раздела вода-воздух (пар) или вода-масло поверхностно-неактивными
веществами будут минеральные соли, кислоты, основания.
Зависимость поверхностного натяжения раствора от концентрации поверхностно-активного вещества выражается эмпирическим уравнением Шишковского:
Δσ=σо-σ =A\n(1+kC), (1.9)
где σо и а - поверхностное натяжение чистого растворителя и раствора на границе с воздухом (паром);
А -константа, мало изменяющаяся для разных веществ;
k - индивидуальная константа, характеризующая поверхностную активность вещества;
С - концентрация вещества в растворе.
Следует обратить внимание на то, что уравнение адсорбции Гиббса, выведенное на основе термодинамических представлений, и закон мономолекулярной адсорбции, открытый Лэнгмюром, в сущности своей тождественны, так как выражают распределение поверхностно-активного ве-
щества между объемом одной из фаз и межфазной поверхностью. Указанное обстоятельство легко подтвердить тем,что, пользуясь уравнением Шишковского, можно перейти от уравнения Гиббса к уравнению Лэнгмюра.
σ = σ0 – a ln (1+ bc) (1.10)
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 3312; Нарушение авторских прав?; Мы поможем в написании вашей работы!