
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия при непосредственном контакте различных металлов
Основные случаи электрохимической коррозии
Электрохимическая коррозия
В природных условиях в большинстве случаев коррозия металлов протекает по электрохимическому механизму. При этом разрушение металлов может происходить на воздухе, в растворах электролитов, в почве, в морской и пресной воде, в бетоне и т.д.
Сущность электрохимического механизма коррозии металлов заключается в том, что атомы окисляющегося металла и частицы окислителя не находятся в непосредственном контакте друг с другом, а передача электронов от атома металла к окислителю происходит через металл, или поверхность контакта разных металлов.
На любой металлической поверхности есть точки или участки неодинакового потенциала. Это анодные и катодные участки: Е°анода< Е°катода.
Анодные участки - места коррозии (так как именно на аноде всегда происходит процесс окисления). На катоде восстанавливаются ионы или молекулы, содержащиеся в электролите. То есть, в основе электрохимической коррозии лежит функционирование самопроизвольно возникающих гальванических пар за счет разности потенциалов на различных участках металлической конструкции.
Необходимым условием электрохимической коррозии является наличие контакта металла с электропроводной жидкостью, которой может быть раствор электролита, вода в природе, в трубах или аппаратах, или даже тонкая плёнка влаги на поверхности металла во влажном воздухе.
Рассмотрим коррозию железа, находящегося в контакте с медью в кислой среде, например водном растворе НС1(рис.11). В образующемся гальваническом элементе анодом является железо (Е° Fe/Fe2+ = -0,44 В), а като-
дом - медь (Е°Cu/Cu2+ = +0,34 В), так как Е°анода< Е°катода

Рисунок 11- Коррозии железа при контакте с медью в кислой среде (рН <7)
Следовательно, железо на поверхности окисляется, образующиеся при этом свободные электроны перемещаются от железа к меди (на катод), где участвуют в процессе восстановления ионов водорода (Н+), находящихся в электролите (рН < 7):
Анод: Fe│ Fe° - 2 е → Fe2+
Катод: Сu | 2Н+ + 2 ё → Н2
Если в электролите не содержится кислоты (рН > 7), то анодный процесс не изменится, но на катоде будет восстанавливаться растворённый в воде кислород:

При контакте железа с металлом, имеющим меньший потенциал, например с цинком (E°Zn/Zn2+ = - 0,76 В), в возникающем гальваническомэлементе анодом будет являться цинк, а катодом - железо. Коррозии в данном случае будет подвергаться цинк, а железо разрушаться не будет, так как катодные реакции не затрагивают металл катода:
Анод: Zn│Zn° - 2 ё → Zn2+
Катод: Fe │2Н+ + 2 ё → Н2 (в кислой среде),
или:
Анод:Zn│Zn° - 2 ё → Zn│2
Катод: Fe │О2+2Н2О + 4ё →4(ОН)-│1(в отсутствие кислоты)
Таким образом, контакт с цинком предотвращает коррозию железа, что часто используется для защиты стальных изделий от коррозии. Соединения металлов в сплавах также обладают электропроводностью, а следовательно, могут участвовать в работе гальванических элементов.
Рассмотрим атмосферную коррозию стали (рис. 12).

Рисунок 12 - Атмосферная коррозия стали
В составе стали всегда имеются кристаллиты феррита (железо) и цементита (карбид железа - Fe3C). Так как Е°Fе< Е°Fе3С, то при наличии влаги (электролита) на поверхности стали между кристаллами Fe и Fe3C возникает множество микрогальванических элементов, в которых анодом будут частицы железа (феррита), а катодом - кристаллиты цементита:
Анод:Fe │Fe° - 2 ё → Fe2+ │2
Катод: Fe3С │О2+2Н2О + 4ё →4(ОН)-│1
Образующиеся на аноде и катоде ионы соединяются в нерастворимый гидроксид:
Fe2++ 2ОН- →Fe(ОН)2↓,
который быстро окисляется кислородом воздуха:
4Fe(OH)2↓ + О2 + 2Н2О → 4Fe(OH)3↓
Получающийся таким образом Fe(OH)3 составляет основу ржавчины. При высыхании он может частично или полностью терять воду, превращаясь в метагидроксид FeO(OH), или Fe2О3. Ржавчина представляет собой бурый, рыхлый налет, не защищающий металл от дальнейшего разрушения.
2) Коррозия при неравномерной аэрации разных участков поверхности одного металла
Неравномерная аэрация означает неодинаковое содержание кислорода воздуха в электролите (воде) у разных участков поверхности металла. Известно, что с ростом концентрации растворённого в электролите (воде) кислорода, возрастает и значение электродного потенциала металла.
Если на гладкую железную пластинку нанести каплю водного раствора соли (например, NaCl), то по краям капли (там, где кислорода больше) образуются катодные участки, а анод будет находиться там, где содержание кислорода меньше всего - в центре капли. Там же (на аноде) будет происходить окисление, то есть коррозия железа. По краям капли на поверхности железной пластинки происходит восстановление кислорода с образованием ионов ОН-. Эти ионы образуют с ионами железа нерастворимые гидроксиды (ржавчина) в виде колец между центром и краями капли, как показано на рис.13.
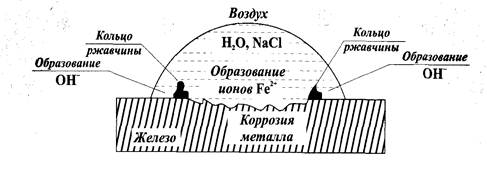
Рисунок 13 - Коррозия железа в условиях неравномерной аэрации
Запишем анодный и катодный процессы:
Анод: Fe - центр капли│Fe° - 2 ё → Fe2+ │2
Катод: Fe - край капли│О2+2Н2О + 4ё →4(ОН)-│1
Аналогичные процессы будут происходить и в других случаях неравномерной аэрации: коррозии в первую очередь подвергается тот участок поверхности металла, доступ кислорода воздуха к которому затруднён.
3) Коррозия под действием блуждающих токов
Источником подземных блуждающих токов могут быть различные устройства, работающие на постоянном токе. Это электропоезда, метро, трамваи, троллейбусы, установки для электросварки, электролизёры и т.д. Коррозию под действием внешнего источника электрического тока называют электрокоррозией.
Рассмотрим коррозию подземного стального трубопровода во влажной почве под действием блуждающих токов (рис.14).

Рисунок 14 - Коррозия подземных коммуникаций под действием блуждающих токов
В месте входа тока в трубопровод возникает катодный участок, и на этом участке будет протекать реакция восстановления молекулярного кислорода, находящегося во влажной почве. Участок металла трубопровода, где происходит выход тока, становится анодом и разрушается.
Запишем анодный и катодный процессы:
Анод: Fe│Fe° - 2 ё → Fe2+ │2
Катод: Fe│О2+2Н2О + 4ё →4(ОН)-│1
Коррозия под действием блуждающих токов обычно приводит к быстрому разрушению подземных металлических конструкций.
|
|
Дата добавления: 2014-11-29; Просмотров: 3908; Нарушение авторских прав?; Мы поможем в написании вашей работы!