
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчинах при 298 К
ПЛАН
- Предмет електрохімії.
- Електропровідність розчинів електролітів, її виміри.
- Електродний потенціал. Рівняння Нернста.
- Класифікація електродів.
5. Корозія металів. Види корозії. Методи захисту від корозії обладнання, що використовується в харчовій і переробній промисловості.
ВИВЧИВШИ ТЕМУ, ВИ ПОВИННІ:
Знати:
P визначення електропровідності, питомої та еквівалентної електропровідності;
P причини, що визивають електропровідність, особливості електропровідності сильних електролітів;
P електродні процеси, електрорушійні сили, електродні потенціали, їх причини;
P рівняння Нернста;
P корозію металів.
Вміти:
P вимірювати електропровідність розчинів;
P вимірювати рН розчинів;
P розраховувати електропровідність розчинів;
P розраховувати електродний потенціал за формулою Нернста;
P розраховувати величину ЕРС;
P складати хімічні гальванічні ланцюги.
1. ПРЕДМЕТ ЕЛЕКТРОХІМІЇ
Електрохімія - це розділ фізичної хімії, в якому вивчаються
закономірності взаємних перетворень хімічної та електричної форм енергії.
Всі електрохімічні процеси можна поділити на дві протилежні групи: І група - процеси електролізу, при якому під дією зовнішнього джерела електричної енергії відбуваються певні хімічні реакції і
ІІ група - процеси виникнення електрорушійної сили та електричного струму внаслідок певних хімічних реакцій.
У процесах І групи електрична енергія перетворюється в хімічну. У
процесах ІІ групи, навпаки, хімічна енергія перетворюється в електричну.
Наприклад, в гальванічних елементах електрична енергія виробляється в результаті перебігу хімічних реакцій. Всі ці процеси йдуть в розчинах або розплавах електролітів і пов’язані із зміною стану іонів. Тому в електрохімії вивчаються властивості розчинів електролітів, іонні рівноваги, електродні процеси.
Електрохімічні процеси мають велике практичне значення. Так, теоретичні закони електрохімії лежать в основі методів одержання хлору, лугів, ряду кольорових та рідкісних металів, вони реалізуються також в процесах гальванотехніки, при роботі хімічних джерел струму, захисті металів від корозії. В науці і техніці широко використовуються електрохімічні методи контролю і аналізу: потенціометрія, кондуктометрія, полярографія, кулонометрія тощо.
Усі електрохімічні реакції відбуваються тоді, коли є електрохімічний струм у колі. Це коло обов’язково складається з послідовно з’єднаних металевих провідників (електродів) і розчину (або розплаву) електроліту. У металевих провідниках, як ми знаємо, переносниками струму є електрони, у розчині електролітів – іони. Безперервність проходження струму в колі забезпечується лише в тому випадку, коли відбуваються процеси на
електродах, тобто на межі метал-електроліт. На одному електроді відбувається процес приймання електронів (відновлення), на другому електроді - процес віддавання електронів (окиснення).
Особливістю електрохімічних процесів, на відміну від звичайних хімічних, є просторове розділення процесів окислення і відновлення. З цих процесів, які не можуть відбуватися один без одного, і складається в цілому хімічний процес в електрохімічній системі.
2. ЕЛЕКТРОПРОВІДНІСТЬ РОЗЧИНІВ ЕЛЕКТРОЛІТІВ,
ЇЇ ВИМІРИ
Електропровідність розчинів електролітів характеризує його здатність проводити електричний струм.
Вона є величиною, оберненою електричному опору. В свою чергу опір R залежить від довжини провідника L, площі поперечного перерізу S і питомого опору ρ:
R = р 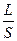 ; р =
; р = 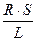
Розрізняють питому і еквівалентну електропровідність розчинів електролітів.
Питома електропровідність – електропровідність розчину електроліту, що міститься між двома електродами площею по 1см2 кожний, розташованими на відстані 1см один від одного.
Питома електропровідність χ– це величина, обернена питомому опору ρ:
χ = 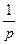 =
= 
Питома електропровідність χ вимірюється:
[ χ ] =  =
= 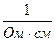 = См/см
= См/см  = См (Сіменс)
= См (Сіменс)
 Зі збільшенням концентрації електроліту, а, отже, і концентрації іонів, питома електропровідність зростає до деякої межі. При досить великій концентрації зменшується ступінь дисоціації (в розчинах слабких електролітів) або зростає вплив взаємного притягання іонів (в розчинах сильних електролітів), що приводить до зменшення електропровідності. Особливо виразно такий характер цієї залежності проявляється для розчинів сильних електролітів.
Зі збільшенням концентрації електроліту, а, отже, і концентрації іонів, питома електропровідність зростає до деякої межі. При досить великій концентрації зменшується ступінь дисоціації (в розчинах слабких електролітів) або зростає вплив взаємного притягання іонів (в розчинах сильних електролітів), що приводить до зменшення електропровідності. Особливо виразно такий характер цієї залежності проявляється для розчинів сильних електролітів.
Рис. 11. Залежність питомої електропровідності розчинів від їх концентрації.
 Залежність питомої електропровідності від температури досить складна, бо визначається багатьма параметрами: в'язкістю середовища, ступенем дисоціації електроліту, гідратацією його іонів, швидкістю їх руху та ін. Найчастіше при збільшенні температури на один градус електрична провідність зростає приблизно на 2%. Це зумовлює необхідність термостатувати розчин при точних вимірюваннях.
Залежність питомої електропровідності від температури досить складна, бо визначається багатьма параметрами: в'язкістю середовища, ступенем дисоціації електроліту, гідратацією його іонів, швидкістю їх руху та ін. Найчастіше при збільшенні температури на один градус електрична провідність зростає приблизно на 2%. Це зумовлює необхідність термостатувати розчин при точних вимірюваннях.
Рис. 12. Співвідношення між питомою та молярною електропровідністю.
Таким чином, питома електропровідність – це функція багатьох чинників. Визначивши цю величину експериментально, ми, проте, не маємо можливості зробити певні висновки про фізико-хімічні властивості даного розчину електроліту. Тому для зручності врахування впливу концентрації на провідність електролітів Е.Х.Ленц увів поняття про еквівалентну (молярну) електропровідність.
Для характеристики електричної провідності розчинів електролітів частіше використовують еквівалентну електропровідність.
Еквівалентна електропровідність λ – це електропровідність об’єму розчину, в якому міститься 1 моль еквівалента розчиненої речовини і який помістили між електродами, відстань між якими дорівнює 1 см.
На рис.12 видно, що “робоча” площа електродів визначається об’ємом розчину. Одиниця еквівалентної електропровідності.
[ λ ] = 
У системі СІ термін «еквівалентна електропровідність» замінено на молярну. Між еквівалентною і питомою електропровідністю існує наступна залежність:
λ = 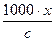 ,
,
де с – еквівалентна концентрація розчину електроліту, що виражається в 
Еквівалентна провідність при розведенні розчину (зменшенні концентрації) збільшується, досягаючи при досить великому розбавленні максимального і постійного значення (рис. 13).
Це граничне значення молярної провідності називають молярною електропровідністю при нескінченному розбавленні і позначають λ∞.
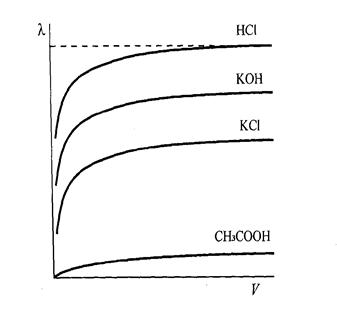
Рис.13. Залежність молярної електропровідності деяких електролітів від розбавлення розчинів.
З рис.13 бачимо, що навіть у дуже концентрованих розчинах сильних електролітів (кислоти, луги, солі) молярна електропровідність досить висока. У сильних електролітах всі молекули дисоційовані. Проте при зменшенні концентрації розчинів спостерігається помітне зростання електропровідності в основному за рахунок послаблення між іонної взаємодії. У концентрованих розчинах слабких електролітів ступінь дисоціації, а отже, й молярна електропровідність дуже незначні. Зі зменшенням концентрації розчину ступінь дисоціації електроліту збільшується, що зумовлює зростання молярної електропровідності, яка прямує до граничного значення λ∞ для нескінченно розбавленого розчину.
Таблиця 1.7
Молярна електропровідність деяких електролітів у водних
| Концентрація, кмоль/м3 | λ, См ∙м2 ∙ кмоль | |||||
| КСl | AgNO3 | HCl | KOH | CH3COOH | NH4OH | |
| 1,0 | 9,83 | 6,78 | 30,1 | 18,4 | 0,132 | 0,089 |
| 0,1 | 11,20 | 9,43 | 35,1 | 21,3 | 0,46 | 0,330 |
| 0,01 | 12,24 | 10,78 | 37,0 | 22,8 | 1,43 | 0,960 |
| 0,001 | 12,73 | 11,32 | 37,7 | 23,4 | 4,10 | 2,800 |
| 0,0001 | 12,91 | 11,50 | - | - | 10,70 | 6,600 |
В безмежно розведеному розчині досягається повна дисоціація молекул (α = 1) і взаємодія між іонами відсутня. Кожний з іонів рухається незалежно від інших і еквівалентна електропровідність в такому випадку може бути представлена як сума електропровідностей іонів. Та частина еквівалентної електропровідності, яка приходиться на іони одного виду, називається рухливістю іону.
Еквівалентна електропровідність при великому розбавленні розчину дорівнює сумі рухливостей іонів:
λ∞ = la+ lk
де laі lk - рухливість аніона і катіона.
Це рівняння називається законом незалежного руху іонів або законом Кольрауша (німецький фізик).
Рухливість іонів виражається в тих самих одиницях, що й еквівалентна електропровідність: [ l ] =  =
= 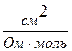
Знаючи рухливість іонів, за законом Кольрауша можна розрахувати еквівалентну електропровідність при безмежному розбавленні.
Рухливість іонів пропорційна швидкості їх руху в електричному полі і тому залежить від розмірів і степені гідратації іонів.
 |
Чим більший радіус іону і чим вищий ступінь його гідратації, тим менша рухливість. Досить високу рухливість мають іон гідрогену Н+ і гідроксид іон ОН-. Це пояснюється тим, що механізм переміщення цих іонів у воді відрізняється від механізму руху інших іонів.
Рис.14. Відносні розміри іонів лужних металів (суцільні кола) та розміри цих іонів у гідратних оболонках (пунктирні кола).
В водних розчинах іон гідрогену знаходиться у вигляді гідроксонія Н3О+. В електричному полі протон іону гідроксонію переходить до найближчої молекули води. Знов утворений іон гідроксонію передає свій протон наступній молекулі води. Аналогічно переміщується протон в розчині від молекули води до гідроксид-іону. В обох випадках перенесення електрики здійснюється не рухом іонів, а в результаті перестрибування протону від одної частинки до іншої.

 _ Н2О Н2О Н2О Н3О+ Н2О Н2О +
_ Н2О Н2О Н2О Н3О+ Н2О Н2О +
_ Н2О Н2О Н2О ОН- Н2О Н2О +
Оскільки протон в молекулі води зв’язаний міцніше, ніж в (Н3О+) гідроксонії, то рухливість гідроксид-іону менша, ніж рухливість іонів гідрогену.
Вимірювання електропровідності
Електропровідність розчинів електролітів визначають, вимірюючи їх опір протіканню електричного струму між двома зануреними в розчин електродами. Зазвичай для цього застосовують змінний струм частотою 500-800Гц, що дозволяє значно зменшити вплив процесів електролізу та поляризації на результати вимірювань. Для дослідів застосовують спеціальні мости опору, одним з плечей яких служить посудина з впаяними платиновими електродами різних конструкцій. Важливо, щоб форма та розміщення електродів, об’єм електроліту і температура під час вимірювань залишались незмінними.
На рис.15 показано конструкцію одного з датчиків, що з успіхом застосовується для вимірювань електропровідності розчинів у лабораторній практиці.
Вимірюючи електропровідність розчинів,  можна визначити розчинність малорозчинних солей у воді чи грунті, вологість різних об’єктів, вміст кислот у розчинах та ін.
можна визначити розчинність малорозчинних солей у воді чи грунті, вологість різних об’єктів, вміст кислот у розчинах та ін.
Рис.15. Схема посудини для вимірювання електропровідності розчинів електролітів:
1 – розчин електроліту; 2 - електроди; 3 - кожух для подачі теплоносія.
3. ЕЛЕКТРОДНИЙ ПОТЕНЦІАЛ. РІВНЯННЯ НЕРНСТА
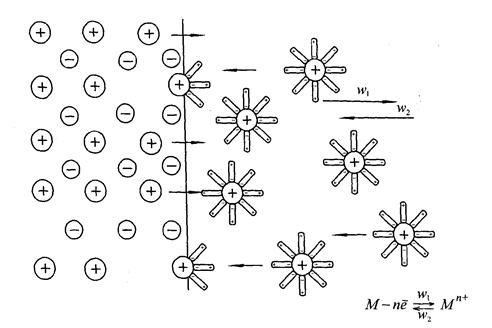 Якщо занурити металеву пластинку (електрод) у розчин електроліту, то між пластинкою і розчином виникає різниця потенціалів, яка має назву електродного потенціалу.
Якщо занурити металеву пластинку (електрод) у розчин електроліту, то між пластинкою і розчином виникає різниця потенціалів, яка має назву електродного потенціалу.
Рис. 16. Перехід іонів металу в розчин під впливом гідратації.
На рис. 16 зображено процеси, що протікають на межі розділу фаз: в результаті гідратації іонів поверхні металу (Меn+) їх зв’язок з кристалічною граткою послаблюється, і вони переходять в розчин. Поверхня металу набуває негативного заряду. Процес швидко досягає стану рівноваги.
При цьому на поверхні металу виникає подвійний електричний шар, падіння напруги в якому називають електродним потенціалом. Кількість іонів, які переходять у розчин з металу, безумовно залежить від їх концентрації в ньому.
Електростатичному притяганню протидіють сили взаємного відштовхування катіонів та їх тепловий рух. Тому подвійний електричний шар має дифузійну будову, концентрація катіону в ньому убуває по мірі віддалення від поверхні металу.
Виникнення подвійного електричного шару пов'язане з протіканням на межі метал – розчин рівноважних електрохімічних реакцій.
Електродний рівноважний потенціал залежить від активності іонів металу в розчині і температури.
Цю залежність виражають рівнянням Нернста:
Е = Ео +  lna,
lna,
де Е - електродний потенціал, В;
Ео – стандартний електродний потенціал – потенціал електроду при активності іонів, що дорівнює 1;
R - універсальна газова стала; R = 8,314  ;
;
Т – температура, К;
n -зарядове число іона;
F - cтала Фарадея; F = 9,648∙104 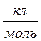
а - активність іонів в розчині.
Для досить розведених розчинів активність іонів в рівнянні Нернста можна замінити моляльністю m,  або концентрацією с:
або концентрацією с:
Е = Ео +  lnm або Е = Ео +
lnm або Е = Ео +  lnс
lnс
Для температури 298 К (25оС) рівняння Нернста при переході від натурального логарифма до десяткового приймає ще постійний вигляд:
Е = Ео +  lgm
lgm
Абсолютне значення електродного потенціалу безпосередньо визначити неможливо. Тому для проведення дослідів застосовують умовну величину, що характеризує потенціал електроду відносно потенціалу іншого електроду, взятого за стандарт (електрод порівняння).
Зазвичай як електрод порівняння використовують стандартний водневий електрод, потенціал якого дорівнює нулю.
Відносно потенціалу цього електроду, всі стандартні потенціали металевих електродів будуть або позитивнішими, або від’ємнішими від нього.
Стандартний електродний потенціал – це електродний потенціал, що виникає при зануренні металу у розчин, в якому активність іонів цього металу становить 1 моль/л.
Якщо розташувати метали в порядку зростання значень їх стандартних потенціалів, то одержимо ряд стандартних електродних потенціалів, або електрохімічний ряд напруг:
Таблиця 1.8
РЯД СТАНДАРТНИХ ЕЛЕКТРОДНИХ ПОТЕНЦІАЛІВ
| Метал | K | Ва | Na | Mg | Al | Zn | Fe | Cd | Co | Ni | Рв |
| Стандарт-ний потенціал, В | -2,92 | -2,91 | -2,71 | -2,36 | -1,66 | -0,76 | -0,44 | -0,40 | -0,28 | -0,25 | -0,13 |
| Метал | Н2 | Cu | Нg | Ag | Рt | Au | |||||
| Стандарт-ний потенціал, В | 0,0 | +0,34 | +0,79 | +0,8 | +1,2 | +1,5 |
Знаючи стандартний електродний потенціал металу, можна розрахувати за рівнянням Нернста його електродний потенціал при будь-якій концентрації іонів в розчині.
Наведені в табл. 1.8 значення Е0 – це кількісні характеристики відомого з курсу загальної хімії ряду напруг. Кожний метал витісняє з розчинів солей метали, розміщені у таблиці правіше нього.
Для неметалів порядок витіснення зворотний: правіше розміщений неметал витісняє з водних розчинів сполук неметал розміщений лівіше. Таким чином можна сказати: іони літію є найслабшими, а атоми флуору найсильнішими окисниками; атоми літію є найсильнішими, а іони флуору найслабшими відновниками.
РЯД ЕЛЕКТРОНЕГАТИВНОСТІ НЕМЕТАЛІВ
|
|
Дата добавления: 2014-11-29; Просмотров: 3717; Нарушение авторских прав?; Мы поможем в написании вашей работы!