
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вплив тиску 1 страница
Агрегатний стан речовин
Хімічна реакція відбувається, коли зіштовхуються атоми, молекули або іони речовин, що реагують. Частота зіткнення часток речовин залежить від швидкості їхнього руху. Найбільшу швидкість частки мають у газах, меншу – у рідинах, а найменшу – у твердих речовинах.
Отже, найбільшу швидкість мають реакції між речовинами, що знаходяться в газоподібному стані.
1.3. Площа поверхні зіткнення речовин, що реагують
Гетерогенними – називаються процеси, що відбуваються на поверхні розділу фаз.
Коли однією з речовин, що реагують, є тверда речовина, реакція перебігає на її поверхні. Чим більша поверхня зіткнення речовин, що реагують, тим частіше зіштовхуються частки і тим вища швидкість хімічної реакції. Збільшення площі поверхні зіткнення речовин досягається шляхом їхнього подрібнення. Наприклад, сірником не можна підпалити поліно, а деревна тріска від нього легко спалахує. Реакція сульфатної кислоти з порошком цинку перебігає бурхливо, а з гранулами Zn набагато спокійніше.
При подрібненні твердих речовин збільшується їх загальна площа і доступ молекул іншого реагенту значно поліпшується. Загальна площа поверхні усіх часточок цинкового порошку значно перевищує площу поверхні гранули металу. Тому порошок цинку швидше взаємодіє з кислотою.
Для гетерогенних реакцій швидкіть прямопропорційна площі поверхні реагуючих речовин.
Цим пояснюються пірофорні властивості деяких матеріалів. Так, в дуже подрібненому (високодисперсному) стані здатні самоспалахувати залізо, нікель, цукор. Це слід враховувати на цукропереробних підприємствах та млинах.
При підвищенні тиску в системі, згідно з відомим законом Бойля-Маріотта, відбувається зменшення загального об’єму:
P1V1 = P2V2
і прямо пропорційно зростає концентрація реагуючих речовин. Тому для хімічної реакції:
N2(г) + 3Н2(г) = 2NH3 (г)
можна записати кінетичне рівняння -
ύ = К∙РN2 • Р3H2,
де РN2 і РH2 - парціальні тиски газів.
1.5. Концентрація реагуючих речовин
Цей фактор є одним з основних, що визначає швидкість хімічних реакцій. Це пояснюється тим, що для взаємодії між молекулами необхідно, щоб вони зіткнулися, тому чим вища концентрація реагуючих речовин, тим більше молекул знаходиться в одиниці об’єму і тим частіше вони стикатимуться одна з одною. Кількість зіткнень частинок цієї речовини із частинками іншого реагенту збільшується, і швидкість реакції зростає.
Залежність швидкості простих хімічних реакцій від концентрації була відкрита у 1867 році К.М.Гульдбергом і П.Вааге і має назву закон діючих мас, за яким:
Швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин, що беруться в степені, який дорівнює стехіометричному коефіцієнту, що стоїть перед формулою речовини в рівнянні реакції.
Н2 (г) + Сl2(г) = 2НСl(г) ύ = К • CН2г • ССl (г)
N2(г) + 3 Н2(г) = 2NH3 (г) ύ = КCNг • C3H2
Fe (т) + 3Сl 2(г) = 2 FeСl3(т) ύ= К • C3Сl2 (г)
С (т) + О2 (г) = СО2(г) ύ = К • CО2
В загальному вигляді формула швидкості реакції між речовинами А і В записується у вигляді:
ύ = К∙СnА∙ СmВ (4.2)
де СА і СВ- концентрації речовин А і В;
n і m –стехіометричні коефіцієнти;
К– коефіцієнт пропорційності, що називається константою швидкості. Якщо прийняти СА = СВ = 1, то ύ = К.
Константа швидкості реакції чисельно дорівнює швидкості реакції при концентраціях реагуючих речовин, що дорівнюють 1моль/л.
Константа швидкості визначається природою реагуючих речовин і залежить від температури і каталізатора, але не залежить від концентрації реагуючих речовин. Рівняння (4.2) називається кінетичним рівнянням. Тверді речовини до кінетичного рівняння не входять.
По мірі протікання хімічних реакцій швидкість їх зменшується, бо вихідні речовини витрачаються і їх концентрація знижується. А константа швидкості незалежно від зміни концентрації залишається постійною: К(С)=const.
2. ЗАЛЕЖНІСТЬ ШВИДКОСТІ РЕАКЦІЇ ВІД ТЕМПЕРАТУРИ
Крім концентрації реагуючих речовин іншим важливим фактором, що впливає на швидкість реакції, є температура. З підвищення температури швидкість хімічних реакцій збільшується. При підвищенні температури зростає швидкість руху молекул і, відповідно, збільшується кількість зіткнень між ними. Тому, чим вище температура, тим більша швидкість реакції. Однак розрахунки показують, що при підвищенні температури на 1000С кількість зіткнень між молекулами збільшується тільки в 1,2 рази, в той час, як швидкість зростає більше ніж в тисячу разів. Тому збільшення числа зіткнень між молекулами не є головною причиною такого значного збільшення швидкості реакції при нагріванні.
З рівняння (4.2) видно, що в цьому випадку збільшення пов’язано із збільшенням К, бо концентрація речовин від Т не залежить. Якщо позначити черезКт, константу швидкості реакції при температурі Т, а через Кт+10 константу швидкості при Т на 100 С більшій, то відношення цих констант буде дорівнювати температурному коефіцієнту швидкості реакції γ: γ = Кт +10
Кт
Значення коефіцієнту γ коливається в межах від 2 до 4.
При підвищенні температури на 100С швидкість хімічної реакції збільшується в 2- 4 рази. Це є правило Вант – Гоффа. Якщо прийняти, що температурний коефіцієнт γ = 2, то при нагріванні реагуючих речовин від 20 до 1000С швидкість реакції збільшиться в 256 разів:
Кт +80
γ =2; γ = Кт = 28 = 256.
Таким чином, збільшення температури в арифметичній прогресії приводить до збільшення швидкості реакції в геометричній прогресії.
Правило Вант – Гоффа наближене і може застосовуватися до реакцій, що протікають при температурі від 00 до 3000С і в невеликому температурному інтервалі.
З підвищенням температури температурний коефіцієнт швидкості реакцій зменшується, наближаючись до 1.
Більш точна залежність швидкості хімічної реакції (константи швидкості) від температури Т експериментально встановлена Арреніусом (швецьким фізикохіміком, лауреатом Нобелевської премії).
ℓn  К = B -
К = B - 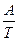 , де А і В – постійні для даної реакції.
, де А і В – постійні для даної реакції.
Заслуга С.Арреніуса полягає не лише в тому, що він знайшов залежність швидкості реакції від температури. Він пояснив природу цієї залежності, показавши, що далеко не кожне зіткнення двох молекул веде до хімічної взаємодії. Якби всі зіткнення молекул у газовій фазі закінчувались хімічною взаємодією, такі реакції протікали б зі швидкістю вибуху.
Щоб зруйнувалися старі зв’язки й утворилася нова речовина, молекули повинні мати надлишкову енергію, що називається енергією активації даної реакції. Молекули, які мають таку енергію, називаються активними молекулами. При підвищенні температури різко збільшується число активних часток.
Енергія активації – надлишок енергії, яку повинні мати молекули (частинки) реагуючих речовин, щоб перетворитися на активні.
Таке пояснення природне, тому що реакції повинні передувати ослаблення та руйнування хімічних зв’язків у реагуючих молекулах, на що потрібна витрата енергії. Величина енергії активізації визначається природою реагуючих речовин. Отже, з підвищенням температури енергія активації залишається постійною, проте зростає число молекул, що мають необхідний запас енергії.
Тільки активні молекули, що мають у момент зіткнення необхідний надлишок енергії, можуть подолати енергетичний бар’єр і вступити у хімічну взаємодію. Число їх тим більше, чим менша величина енергетичного бар’єра.
Звичайно енергія активації у 3-5 разів менша енергії розриву хімічних зв’язків. Це означає, що для проходження реакції не потрібно повністю руйнувати старі молекули, а досить їх лише активувати, послабити хімічні зв’язки між атомами.
Теорія активних зіткнень Арреніуса має такий істотний недолік – вона не враховує час, необхідний для перерозподілу зв’язків і утворення нових молекул.
Вплив температури на швидкість біохімічних процесів має більш складний характер. З підвищенням температури швидкість цих процесів також збільшується, але до певної температурної межі, вище якої швидкість процесу різко зменшується.
3. СКЛАДНІ РЕАКЦІЇ. ЛАНЦЮГОВІ РЕАКЦІЇ
Більшість реальних хімічних процесів представляє собою сукупність декількох простих хімічних реакцій, пов’язаних між собою. До таких складних реакцій належать паралельні, зворотні, послідовні і спряжені реакції. Такі реакції проходять через низку простих послідовних, а іноді паралельних реакцій, які називаються елементарними. Сукупність елементарних стадій, через які здійснюється перетворення початкових речовин у продукти реакції, тобто шлях, через який проходить реакція, називається механізмом реакції. Ці елементарні стадії можуть бути зворотними чи незворотними.
Паралельними реакціями називають такі реакції, в яких одні й ті самі вихідні речовини, реагуючи одночасно, утворюють різні продукти.
Схематично паралельні реакції можна представити рівнянням:

 К1 В
К1 В
 А К1 B або 2А→
А К1 B або 2А→

 А К2 C К2 C
А К2 C К2 C
Прикладом такої реакції може служити розкладання при нагріванні бертолетової солі (КСlО3), яке може йти в двох направленнях:

 2КСlО3 К 1 2КСl + 3О2 і 4 КСlО3 К2 3КСlО4 + КCl
2КСlО3 К 1 2КСl + 3О2 і 4 КСlО3 К2 3КСlО4 + КCl
На відміну від кінетичних рівнянь простих реакцій кінетичне рівняння паралельних реакцій включає кілька констант швидкостей.
До зворотних реакцій відносяться такі, які йдуть як в прямому, так і в зворотному напрямках.
В загальному вигляді це рівняння записують так:
К1

 А B
А B
К2
Швидкість такої реакції дорівнює різниці швидкостей прямої ύ1, і зворотної ύ2 реакцій ύ = ύ1 – ύ2. наприклад, сахароза, взаємодіючи за певних умов з водою, дає глюкозу і фруктозу. Водночас глюкоза і фруктоза, відщеплюючи воду, перетворюється в сахарозу:
 Н2О + С12Н22О11 С6Н12О6 + С6Н12О6
Н2О + С12Н22О11 С6Н12О6 + С6Н12О6
сахароза глюкоза фруктоза
Швидкість прямої реакції з часом зменшується, швидкість зворотної реакції збільшується. При досягненні рівності цих швидкостей (ύ1 – ύ2) настає стан рівноваги.
Послідовні реакції проходять в декілька реакцій - проміжних стадій, що йдуть одна за одною:


 А К1 В К2 С К3 Д...
А К1 В К2 С К3 Д...
Кожна з цих стадій являє собою моно- або бімолекулярну реакцію, в результаті якої утворюються проміжні речовини. До послідовних реакцій відносяться, наприклад, гідроліз ефірів і полісахаридів, термічний крекінг вуглеводів.
Швидкість послідовних реакцій визначається найбільш повільною стадією.
Спряженими реакціями називають реакції виду:
 А + В М
А + В М
 А + С N
А + С N
Характерною особливістю спряжених реакцій є те, що якщо перша реакція може йти самостійно, то друга йде тільки сумісно з першою.
Без першої реакції не йде й друга.
Так, наприклад, йодоводнева кислота не окислюється таким сильним окисником, як пероксид водню. Але разом з сульфатом феруму (ІІ), який легко окислюється пероксидом водню, буде окислюватися й йодоводнева кислота. Таким чином, реакція окислення FeSO4 індукує витіснення йодоводневої кислоти. Загальною речовиною А для обох розглянутих реакцій є пероксид водню (актор), сульфат феруму (речовина В) служить індуктором, а НІ - акцептором.
Ланцюгові реакції
Багато хімічних реакцій відбуваються через проміжні стадії, в яких беруть участь активні частинки – вільні радикали і атоми. Якщо ці активні частинки регенеруються протягом реакції, то це забезпечує її високу швидкість. Такі процеси називаються ланцюговими.
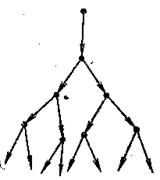 Ланцюгові реакції дуже поширені і мають велике практичне значення. Велику роль у створенні і розробці теорії ланцюгових процесів відіграли праці радянського вченого, лауреата Нобелівської премії академіка М.М.Семенова та його учнів.
Ланцюгові реакції дуже поширені і мають велике практичне значення. Велику роль у створенні і розробці теорії ланцюгових процесів відіграли праці радянського вченого, лауреата Нобелівської премії академіка М.М.Семенова та його учнів.
Рис. 17. Схема лавиноподібного розвитку розгалуженої ланцюгової реакції
Розрізняють ланцюгові процеси з розгалуженими (рис.17) і нерозгалуженими ланцюгами.
Кожний ланцюговий процес починається з утворення вільного радикала або атома – активних частинок, які, на відміну від молекул, мають ненасичені валентності. Такі активні частинки утворюються під дією якогось джерела енергії.
Потім відбувається взаємодія вільного радикала або атома з молекулами. Внаслідок цього в молекулі розривається валентний зв’язок і утворюється новий радикал або атом, який знову реагує з молекулами. Багаторазове повторення таких реакцій і утворює ланцюг.
Ланцюговими реакціями з нерозгалуженим ланцюгом називають реакції, під час яких при взаємодії однієї активної частинки щоразу утворюється лише одна нова активна частинка і кількість їх при розвитку ланцюга не збільшується.
Ланцюговими реакціями з розгалуженими ланцюгами називають реакції, під час яких внаслідок взаємодії активної частинки утворюються дві активні частинки або більше, та кількість їх швидко збільшується, і відповідно зростає швидкість хімічної реакції.
Розглянемо ланцюгову реакцію з нерозгалуженим ланцюгом — реакцію взаємодії водню з хлором. Ці реакції практично не проходять в темряві, бо для утворення НСl з Н2 і Сl2, потрібна велика енергія активації. Якщо суміш водню і хлору опромінити видимим світлом або потоком радіоактивних частинок, то утворюються атоми хлору:
С12 + hv → 2Сl•
Після цього починає розвиватись ланцюг:
Cl• + H2 → HCl + H•,
H• + Cl2 → HCl + Cl•,
Cl• + H2 → HCl + H• і т. д.
Як видно з наведених реакцій, одна активна частинка при взаємодії зникає і утворює лише одну нову активну частинку (атом Гідрогену або Хлору). Отже, число активних частинок не збільшується. Якщо опромінення швидко припинити, то кількість активних частинок навіть зменшуватиметься внаслідок реакцій рекомбінації вільних радикалів у молекулу:
Н• + •Сl →НСl,
Н• + •Н → Н2,
Сl• + •Сl → Сl2.
Зазначені реакції призводять до обриву ланцюга; вільні атоми (атом-радикали) зникають, а нові активні частинки не утворюються.
Зауважимо, що ймовірність реакцій рекомбінації значно менша, ніж реакцій основного ланцюга, тому що концентрація молекул водню і хлору в системі на кілька порядків більша, ніж концентрація атомів. Ймовірність зіткнення атомів Н• з молекулами Сl2 (або Сl• з Н2) значно більша, ніж імовірність зіткнення атомів між собою.
Крім того, з'єднання двох однакових атом-радикалів, наприклад атомів водню, в молекулу можливе лише в тому разі, коли в момент зіткнення атоми віддають надлишок енергії якому-небудь тілу.
Отже, при ланцюгових реакціях з нерозгалуженим ланцюгом кількість активних частинок не тільки не збільшується при розвитку ланцюга, а навіть може частково зменшуватись внаслідок рекомбінації атомів-радикалів і обриву ланцюга. Водночас такі ланцюгові реакції можуть призвести до вибуху. Так, якщо суміш хлору з воднем при їх досить великій концентрації на короткий час освітити, то відбудеться реакція з вибухом. Вибух у цій реакції має тепловий характер.
Тепловий вибух буде тоді, коли швидкість виділення тепла при проходженні реакції значно перевищує швидкість віддачі системою тепла зовнішньому середовищу. Внаслідок цього температура реакційної суміші швидко підвищується, відповідно швидко зростає і швидкість реакції.
Отже, підвищення температури автокаталітично прискорює реакцію, внаслідок чого станеться вибух.
Взагалі для будь-якої реакційної суміші (якщо реакція екзотермічна) при досить високій концентрації реагентів швидкість виділення тепла перевищує швидкість його віддачі. Такі системи завжди вибухають. Для посудини певного розміру з певною початковою температурою існує гранична концентрація реагентів, вище якої станеться вибух. Усе це докладно описав М. М. Семенов.
У газових системах тепло, яке виділяється під час реакції, надходить лише в зовнішнє середовище. У розчинах тепло, яке виділяється при реакції, значною мірою поглинається розчинником, який безпосередньо не бере участі в реакції. Все це знижує можливість різкого підвищення температури розчину. Крім того, підвищенню температури перешкоджає ендотермічний процес фазового переходу рідини в газ.
При ланцюгових реакціях з розгалуженим ланцюгом прогресивно і швидко зростає концентрація активних частинок, що призводить до катастрофічного зростання швидкості реакції і до вибуху. Таким чином, основним автокаталітичним фактором тут є збільшення кількості активних частинок. Характерною реакцією цього типу є реакція водню з киснем, яку докладно вивчив академік В. М. Кондратьєв. Внаслідок безпосередньої взаємодії молекул О2 і Н2утворюються радикали •ОН, Н• і НО2:
Н2 + О2 = 2•ОН; Н2 + О2 = Н• + НО2.
Ці реакції відбуваються повільно. Але потім починаються швидкі процеси з участю радикалів:
•ОН + Н2 = Н2О + Н•,
Н• + О2 = • ОН + О•,
О• + Н2 = •ОН + Н•.
Як видно з двох останніх рівнянь, одна активна частинка — атом-радикал Н• приводить до появи трьох нових активних частинок: двох частинок ОН• і одного атом-радикала Н•. Внаслідок цього в реакційній суміші з величезною швидкістю зростає число активних частинок.
З участю вільних радикалів відбуваються різноманітні хімічні процеси — реакції окислення вуглеводнів, реакції полімеризації та ін.
Вільні радикали можуть утворюватись під дією ультрафіолетових і рентгенівських променів, γ-променів, під дією нейтронів або ά-частинок, які спричинюють розрив хімічного зв'язку.
З появою вільних радикалів у клітинах живих організмів пов'язана променева хвороба. Вільні радикали, які утворюються внаслідок радіоактивного опромінення (головним чином, радикал •ОН), спричинюють ланцюговий процес у клітинах, в який втягуються ферменти, білки та інші складові частини клітини.
4. ФОТОХІМІЧНІ РЕАКЦІЇ
Реакції, що протікають під дією світла, називають фотохімічними.
До фотохімічних процесів відноситься велика кількість різних реакцій. Наприклад, на світлові суміш газів Н2 і F2 зривається; аміак розкладається на N2 і Н2 і під дією ультрафіолетового випромінювання утворюється озон з молекулярного кисню. Фотохімічні реакції лежать в основі фотографічних процесів, відбілюючої дії кисневмісних сполук хлору.
Під дією ультрафіолетового випромінювання сонячного світла в шкірі людини синтезується необхідний вітамін Д, що має антирахітичну активність. Синтетичний вітамін Д одержують в промисловості, також використовуючи фотохімічну реакцію.
Під дією світла може змінюватися якість харчових продуктів. наприклад, молоко втрачає вітаміни, набуває неприємного смаку.
Найважливішим фотохімічним процесом є протікання в зелених рослинах процесу фотосинтезу – утворення вуглеводів та інших органічних сполук з СО2 і Н2О під дією енергії сонячного світла, що поглинається зеленим пігментом рослин - хлорофілом:
 6СО2 + 6Н2О С6 Н12О6 + 6О2
6СО2 + 6Н2О С6 Н12О6 + 6О2
Цей процес складний, складається з ряду стадій, багато з яких до цих пір вивчені недостатньо.
Фотосинтез – найважливіший біохімічний процес на Землі, бо це єдине джерело поповнення запасів атмосферного кисню і органічних речовин, які служать їжею для людей і тварин. Основоположником вчення про фотосинтез був російський фізіолог К.А.Тимирязєв.
Фотохімічна дія світла полягає в тому, що атоми і молекули реагуючих речовин, поглинаючи світлові кванти - фотони, збуджуються.
Енергія фотону Е зв’язана з частотою його випромінювання ν співвідношенням:
Е = h ·ν, де
h – постійна Планка, h = 6,626 · 10 –34 Дж/Гц або (Дж ·с).
З цієї формули витікає, що більшу енергію і високу хімічну активність мають світлові промені з більшою частотою, тобто з меншою довжиною хвилі. Найбільш активними є фіолетові промені, найменш активною є червона частина спектра.
При поглинанні світла молекулами речовини посилюється коливальний рух атомів і атомних груп, послаблюється зв’язок між ними, тобто молекули переходять в активний, збуджений стан. У деяких випадках енергія фотону достатня для розриву внутрішньомолекулярних зв’язків.
Між кількістю поглинутої енергії при фотохімічній реакції і кількістю речовини, що прореагувала існує залежність, яка виражається законом фотохімічної еквівалентності Ейнштейна (1912) р.
За цим законом кожна молекула, що реагує під дією світла, поглинає один квант випромінювання, який викликає реакцію.
Експериментальна перевірка закону фотохімічної еквівалентності показала, що іноді числомолекул, якіпрореагували, не дорівнюєчислупоглинутихквантів. Тому для кінетичної характеристики фотохімічних реакцій введено поняття квантового виходу.
Квантовим виходом фотохімічної реакції æ називається відношення числа молекул N, що прореагували, до числа поглинутих квантів світла n:
N
 æ = n
æ = n
За законом фотохімічної еквівалентності квантовий вихід повинен дорівнювати 1, але зустрічаються реакції, у яких він або більше 1, або менше 1.
Відхилення від закону фотохімічної еквівалентності пов’язані з різними вторинними процесами. Так æ < 1 спостерігається в тих випадках, коли частина фотонів поглинається молекулами сторонніх речовин, що знаходяться в суміші з реагуючими речовинами.
æ > 1 може бути обумовлений тим, що перетворення, визвані поглинанням молекулою кванту світла, приводять до утворення активних частинок, які вступають у вторинні “теплові” реакції. Наприклад, при
фотохімічному розкладанні бромоводню первинний процес зводиться до дисоціації його на атоми:
 НВr hν Н∙ + Вr∙
НВr hν Н∙ + Вr∙
Потім ідуть вторинні реакції:

 НВr + Н∙ Н2 + Вr; Вr∙ + Вr∙ Вr2
НВr + Н∙ Н2 + Вr; Вr∙ + Вr∙ Вr2
Загальна схема процесу:
 2НВr hν Н2 + Вr2; æ =2
2НВr hν Н2 + Вr2; æ =2
Таким чином, відхилення від закону фотохімічної еквівалентності викликаються вторинними процесами.
Первинні ж перетворення, безпосередньо пов’язані з поглинанням світла, добре описується законом Ейнштейна.
- КАТАЛІЗ І КАТАЛІЗАТОРИ
Швидкість хімічної реакції змінюється за наявності деяких речовин. У багатьох випадках скерувати реакцією в бажаному напрямку, а також різко збільшити її швидкість вдається за допомогою каталізаторів.
Каталізатори – це речовини, що змінюють швидкість хімічної реакції, але самі при цьому не витрачаються і не входять до складу кінцевих продуктів реакції.
Каталітичні реакції дуже різноманітні. Вони відіграють винятково важливу роль у живій природі і мають широке промислове застосування.
Каталіз – явище зміни швидкості реакції під дією каталізаторів.
Прикладом позитивного каталізу є наявність нікелю в реакціях гідрування жирів, ферментів у біохімічних процесах.
Інгібітори – каталізатори, що сповільнюють швидкість хімічної реакції.
До інгібіторів належать антиокисники, антистарителі. Їх застосовують для затримки старіння каучуків, пластмас, а антиокисники сповільнюють окиснення органічних речовин. Наприклад, згіркненню жирів перешкоджає лимонна та аскорбінова кислоти.
Речовини, які запобігають псуванню харчових продуктів, називають консервантами.
Особливим випадком каталізу є автокаталіз.
Автокаталіз – явище прискорення хімічної реакції одним із її продуктів.
Характерною особливістю автокаталітичної реакції є збільшення її швидкості з накопиченням продукту реакції. Далі у зв’язку зі зниженням концентрації вихідних речовин швидкість реакції зменшується.
Розрізняють два види каталізу: гомогенний і гетерогенний.
Гомогенним називається каталіз, при якому і каталізатор і реагенти знаходяться в одному агрегатному стані.
Для пояснення механізму гомогенного каталізу була запропонована теорія проміжних сполук. Вона була викладена в працях Оствальда в 1884-1911рр. Згідно з цією теорією, каталізатор утворює з однією із реагуючих речовин нестійку проміжну сполуку – комплекс, яка далі взаємодіє з іншими реагентами; при цьому каталізатор вивільнюється у незмінному вигляді. Наприклад, якщо реакція типу:
А + В = АВ
відбувається повільно, то підбирають каталізатор К, який з однією із вихідних речовин реагує з більшою швидкістю, тобто отримують –
А + К = АК
Далі речовина АК з більшою швидкістю реагує з речовиною В і, таким чином, отримують: АК + В = АВ + К
Уцих рівняннях АК – проміжна сполука.
Збільшення швидкості реакції при гомогенному каталізі пояснюється тим, що кожна із стадій характеризується низькою енергією активації і, відповідно, відбувається з більшою швидкістю.
Існують такі типи гомогенного каталізу: кислотно-основний, окисно-відновний, координаційний, гомогенний газофазний, ферментативний.
Приклад гомогенного каталізу – каталітичний розклад гідроген пероксиду в присутності розчину солей (рідка фаза). При гомогенному каталізі швидкість хімічної реакції пропорційна концентрації каталізатора.
|
|
Дата добавления: 2014-11-29; Просмотров: 1280; Нарушение авторских прав?; Мы поможем в написании вашей работы!