
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектрофотометрия
|
|
|
|
Для получения температурно-пертурбационных дифференциальных спектров (ТПДС) раствор белка одинаковой концентрации заливается в кварцевые кюветы, которые располагаются в термостатированных ячейках спектрофотометра. При создании разности температур между кюветами регистрируется характерный температурно-пертурбационный дифференциальный спектр, который состоитиз вкладов поглощения триптофановых, тирозиновых и фенилаланиновых остатков, доступных растворителю и изменяющих спектры поглощения в результате изменения структуры растворителя под влиянием температуры.
Каждый из хромофоров имеет свой характерный ТПДС. На рис.3б представлен ТПДС триптофана, возникающий в результате разности температур между кюветами, DT=10°. Дифференциальный спектр по форме близок к первой производной  от спектра поглощения триптофана (см. рис.3а).
от спектра поглощения триптофана (см. рис.3а).
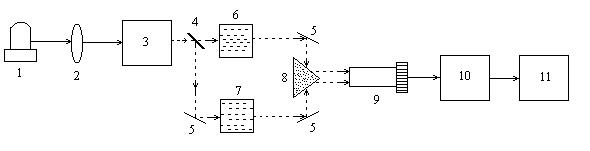
Рис. 2. Блок-схема спектрофотометра.
1— источник света; 2 — линза; 3 — монохроматор; 4 — полупрозрачное зеркало; 5 — отражающие зеркала; 6 —кювета с раствором; 7 —кювета сравнения с растворителем; 8 — призма; 9 — ФЭУ; 10 — усилитель; 11 — самописец.
Для ТПДС триптофана характерно наличие ряда узких максимумов: положительные 293 и 285 нм и отрицательные 289, 278 и 270 нм. Аналогичным путем получены маркерные ТПДС тирозина и фенилаланина. В ТПДС тирозина – положительные максимумы 287 и 279 нм и отрицательные 282.5, 275 и 267 им. В ТПДС фенилаланина наблюдается ряд узких положительных максимумов – 268.8, 265.5. 259.5, 253 и 247 нм.
Паспортной характеристикой хромофора является температурный инкремент экстинкции c l:
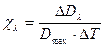 , (5)
, (5)
где DDl – дифференциальная оптическая плотность; Dmax – оптическая плотность хромофора в максимуме спектра поглощения; DT – разность температур. Для триптофана c293=2.12×10-3 град-1; для тирозина c287= 2.12×lO-3 град-1; для фенилаланина c265= 3,09×10-3 град-1.
|
|
|
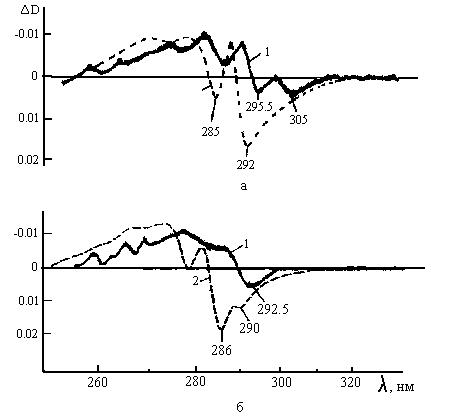
Рис.3. Температурно-пертурбационные дифференциальные спектры (ТПДС):
а – химотрипсиногена А в 0.05М фосфатном буфере, рН = 6,8; б – сывороточного альбумина быка в 0,25M KCI. рН = 6,75; 1 – ТПДС изучаемых белков, 2 –ТПДС водных растворов N – Ас – Туr – Oet и N – Ас – Тrр – NH, взятых в молярном соотношении, соответствующих содержанию тирозина и триптофана в исследуемых белках (а – 4:8; б – 18:2); D280=1,0; градиент температуры в кюветах 15°.
Доля температурно-пертурбируемых хромофоров белка а определяется как отношение температурного инкремента экстинкции белка cs к температурному инкременту экстинкции хромофора cм:
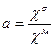 , (6)
, (6)
ТПДС разных белков значительно отличаются между собой; в то же время обычные спектры поглощения для разных белков мало различаются. На рис. 3 представлены ТПДС химотрипсиногена А и сывороточного альбумина быка.
2.4. Сольвентно-пертурбационная дифференциальная спектрофотометрия.
При добавлении в раствор белка пертурбантов (метанола, d = 0,28 нм; этиленгликоля, d = 0,44нм; глицерина, d =0,52нм; глюкозы, d =0,72 нм; сахарозы, d = 0,94 нм, где d – эффективный размер пертурбаната) происходит небольшое смещение спектра поглощения. Если кювету сравнения заполнить раствором белка, а измеряемую кювету — раствором белка и пертурбантом, то на спектрофотометре регистрируется сольвентно-пертурбационный дифференциальный спектр (СПДС). Компенсация поглощения пертурбанта производится использованием двух тандемных кювет. Использование 20% растворов пертурбантов не изменяет конформациюбелковых молекул.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 999; Нарушение авторских прав?; Мы поможем в написании вашей работы!