КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика контактного способу
|
|
|
|
виробництва сульфатної кислоти
| Сировина | Пірит FeS2, самородна сірка, сульфуровмісні гази, повітря |
| Каталізатор | Ванадій (V) оксид |
| Основний хімічний процес | Пірит піддають випалюванню киснем повітря: 4FeS2 + 11O2 → Fe2O3 + SO2 + 3310 кДж Випальний газ після ретельного очищення надходить до контактного апарату, де в присутності каталізатора за температури 450 оС окислюється до SO3. Сульфур (VІ) оксид поглинають концентрованою сульфатною кислотою. Утворюється олеум, з якого виробляють сульфатну кислоту будь-якої концентрації |
| Особливості процесу | 1. Виробництво безперервне. 2. Випал колчедану здійснюють у киплячому шарі, продуваючи в печі повітря, нагріте випальним газом. 3. Ретельно очищений випальний газ перед надходженням до контактного апарату нагрівають за рахунок теплоти, що виходить із контактного апарату. 4. У поглинальних баштах сульфур (VІ) оксид поглинають сульфатною кислотою протитоком. |
Застосування сульфатної кислоти
1. Виробництво кислот, лугів, солей, мінеральних добрив.
2. Виробництво органічних речовин (бензин, толуол, глюкоза), синтетичних миючих засобів
3. Виробництво вибухових речовин.
4. Виробництво штучного шовку, фарб.
5. Як електроліти в акумуляторах.
6. Для очистки нафтопродуктів.
7. Для травлення металів.
Застосування сульфатів у народному господарстві
| Назва солі | Хімічна формула | Застосування |
| Натрій сульфат (глауберова сіль) | Na2SO4 ∙ 10H2O | Для виробництва соди та у скляній промисловості |
| Кристалогідрат ферум (ІІ) сульфат (купорос залізний) | FeSO4 ∙ 7H2O | Як протрава для тканин у фарбувальній справі, у сільському господарстві, для очищення деревини |
| Кристалогідрат купрум (ІІ) сульфат (мідний купорос) | CuSO4 ∙ 5H2O | Для виробництва мідних покриттів та одержання різноманітних сполук Купруму, у сільському господарстві, для очищення деревини |
| Кристалогідрат цинк сульфат (купорос цинковий) | ZnSO4 ∙ 7H2O | У текстильній промисловості, для виробництва білої фарби |
| Магній сульфат | MgSO4 | У текстильній та паперовій промисловості, у медицині як проносне, а також для внутрішньовенних та внутрішньом’язевих вливань, у виробництві будівельних матеріалів |
|
|
|
НЕМЕТАЛИ П’ЯТОЇ ГРУПИ
ЕЛЕМЕНТИ V ГРУПИ ГОЛОВНОЇ ПІДГРУПИ
НІТРОГЕН ТА ФОСФОР
Порівняльна характеристика будови атомів
Нітрогену та Фосфору
| Атом Нітрогену N | Атом Фосфору P | ||||
| Розміщення електронів на енергетичних рівнях | +⑦)) 2 5 | +⑮))) 2 8 5 | |||
| Електронна формула | 1S22S22P3 | 1S22S22P63S23P3 | |||
| Розміщення електронів на орбіталях |
    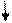                 1S2 2S2 2P3 1S2 2S2 2P3
| 3S2 3P3
   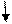 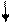           3d0
3d0
|
Алотропні форми фосфору
| Білий (Р4) | Червоний (Р) | Чорний (Р) | |
| Кристалічні решітки | молекулярна | атомна | атомна |
| Фізичні властивості | Кристалічна речовина жовтого кольору, із запахом, світиться в темряві, нерозчинна у воді,отруйна, спалахує на повітрі, внаслідок нагрівання переходить у червоний фосфор | Порошок темно-червоного кольору, без запаху, не отруйний, не спалахує | Тверда речовина, має шарувату будову, жирна на дотик, добре проводить електричний струм, хімічно менш активна, ніж червоний фосфор; у разі тривалого нагрівання та під великим тиском утворюється з білого фосфору |
Порівняльна характеристика Нітрогену та Фосфору
| Ознаки для порівняння | Нітроген | Фосфор |
| Поширення в природі | Зустрічається у вільному стані (становить 78,16% об’єму повітря). У зв’яза-ному стані зустрічається в натрій нітраті, а також вхо-дить до складу білкових речовин і багатьох приро-дних органічних сполук | Зустрічається виключно у вигляді сполук (вміст у зе-мній корі становить 0,093%). Основні мінерали Фосфору – фосфорит і апа-тит, а також входить до складу білкових речовин |
| Фізичні властивості | Безбарвний газ, без запа-ху, переходить у рідкий стан за температури –195,8 оС, за −210 оС твердне | Утворює кілька алотропних видозмін, що значною мі-рою відрізняються фізич-ними властивостями |
| Хімічні властивості а) взаємодія з металами; б) взаємодія з неметалами (киснем, воднем) | 3Mg + N2 → Mg3N2 магній нітрид N2 + O2 ↔ 2NO нітроген (ІІ) оксид N2 + 3H2 ↔ 2NH3 амоніак | 3Mg + 2Р → Mg3Р2 магній фосфід 4Р + 3O2 → 2Р2О3 фосфор (ІІІ) оксид 4Р + 5O2 → 2Р2О5 фосфор (V) оксид 2Р + 3H2 ↔ 2РH3 фосфін |
| Застосування | Наповнюють електро-лампи (створення інерт-ного середовища) | Червоний фосфор засто-совують для виробництва сірників, також фосфор ви-користовують для одер-жання фосфорної кислоти, у виробництві отрутохімі-катів |
|
|
|
Характеристика амоніаку NН3
| Будова молекули | Молекула амоніаку має форму піраміди, в основі якої лежить трикутник з атомів Гідрогену, а у вершині – атом Нітрогену: N ̸ / \ Н Н Н Молекула амоніаку полярна: загальні електронні пари зміщені до атома Нітрогену. Крім того, в атома Нітрогену залишається неподілена пара електронів : NН3 Це збільшує полярність та зумовлює багато властивостей амоніаку |
| Фізичні властивості | Безбарвний газ із різким характерним запахом, легший за повітря, добре розчинний у воді |
| Хімічні властивості: а) розчинення у воді з утворенням розчину амоній гідроксиду; б) горить у кисні; в) взаємодія з кислотами. | NН3 + Н2О ↔ NН4ОН 4NН3 + 3О2 →2N2 + 6Н2О кат. 4NН3 + 5О2 → 4NО + 6Н2О NН3 + НCl → NН4Cl амоній хлорид NН3 + НNO3 → NН4NO3 амоній нітрат |
| Способи одержання | У лабораторних умовах одержують із суміші амоній хлориду та кальцій гідроксиду: 2NН4Cl + Са(ОН)2 → СаCl2 + NН3↑ + Н2О У промисловості одержують шляхом прямого синтезу з азоту та водню: N2 + 3H2 ↔ 2NH3 + 92 кДж |
| Застосування | Виробництво нітратних добрив, нітратної кислоти; у медицині; виробництво вибухових речовин; як холодильний агент у холодильних установках |
| Виявлення амоніаку | У результаті взаємодії концентрованого розчину амоніаку з концентрованою хлоридною кислотою з’являється білий дим амоній хлориду: NН3 + НCl → NН4Cl |
|
|
|
Хімічні властивості солей амонію
| Властивості солей амонію | Хімічне рівняння реакції |
| У водних розчинах дисоціюють на йони | NН4NO3 → NН4+ + NO3− |
| Взаємодія з іншими солями | (NH4)2SO4 + ВаСl2 → ВаSO4 + 2NH4Сl |
| Реагують з кислотами | (NH4)2CO3 + 2HCl → NН4Cl + Н2О + CO2 |
| Унаслідок нагрівання розкладаються | NH4Сl → NH3↑ + HСl↑ |
| Реагують з лугами (якісна реакція на йони амонію) | NН4Cl + KОН → KCl + NН3↑ + Н2О |
Характеристика солей амонію
| Назва солі | Хімічна формула | Застосування |
| Амоній хлорид (нашатир) | NН4Cl | Для пайки металів та нанесення на них покриттів, у текстильній промисловості |
| Амоній сульфат | (NH4)2SO4 | Як нітратне добриво |
| Амоній нітрат (амоніакова селітра) | NН4NO3 | Для виробництва вибухових речовин, а також як добриво |
| Амоній карбонат | (NH4)2CO3 | У хлібопеченні, виробництві вітамінів і харчових концентратів, у медицині |
Порівняльна характеристика оксидів Нітрогену
| Ознаки для порівняння | Нітроген (І) оксид N2O | Нітроген (ІІ) оксид NO | Нітроген (ІV) оксид NO2 | Нітроген (ІІІ) оксид N2O3 | Нітроген (V) оксид N2O5 |
| Ступінь окиснення | +1 | +2 | +4 | +3 | +5 |
| Фізичні властивості | Газ без запаху та кольору, розчинний у воді | Безбарвний газ, добре розчинний у воді | Бурий газ із різким запахом | Темно-синя рідина | Тверда кристалічна речовина |
| Хімічні властивості | Несолетво- рний оксид. Нестійкий, легко роз-кладається на кисень і азот: 2N2O → 2N2+ + O2 | Несолетво- рний оксид. Легко приєднує кисень: 2NO + O2→ →2NO2 | Солетво- рний оксид. Добре розчиняється у воді: 2NO2 + +H2O → →HNO3 + +HNO2 У присут- ності на- длишку кисню: 4NO2+О2+ +2H2O→ →4НNO3 | Солетво- рний оксид. Взаємодія з водою: N2O3+H2O→ 2 НNO2 нітритна кислота Взаємодія з лугами: N2O3+2КOН→ 2КNO2+ + H2O Солі - нітрити | Солетво- рний оксид. Взаємодія з водою: N2O5+H2O→ →2 НNO3 нітратна кислота Взаємодія з лугами: N2O5+2КOН→ 2КNO3+ + H2O Солі - нітрати |
| Фізіологічна дія | У медицині як нарко-тична речо-вина (весе-лильний газ) | Небезпечні для дихання отрути | Багато нітритів отруйні | Багато нітратів отруйні |
|
|
|
Порівняльна характеристика властивостей нітратної та ортофостатної кислот
| Ознаки для порівняння | Нітратна кислота | Ортофосфатна кислота |
| Фізичні властивості | Безбарвна рідина (внас-лідок зберігання жовтіє). Змішується з водою в будь-яких співвідношеннях. Безводна кислота “димить” на повітрі | Тверда, прозора криста-лічна речовина. Змішується з водою в будь-яких пропо-рціях |
| Хімічні властивості: а) дисоціація на йони; б) взаємодія з металами; в) взаємодія з основними оксидами; г) взаємодія з основами; д) взаємодія із солями; е) термічний розклад | Сильний електроліт: НNO3 → Н+ + NO3− Порівняно з іншими кисло-тами з металами реагує інак-ше (див. схему) CaO + 2НNO3 → Ca(NO3)2 + H2O Fe(OH)2 + 2НNO3 → Fe(NO3)2 + +2Н2O К2СО3 + 2НNO3 → 2КNO3+H2O+ + CO2↑ t, cвітло 4НNO3 ―――→2Н2O+4NO2↑+ + O2↑ | Електроліт середньої сили, дисоціює ступінчасто: Н3РО4 → Н+ + Н2РО4− Н2РО4− → Н+ + НРО42− НРО42− → Н+ + РО43− Реагує тільки з активними металами: 6Na +2Н3РО4→Na3PO4+ 3H2↑ 3CaO + 2 Н3РО4 → Ca3(РО4)2 + + 3H2O Н3РО4 + 3NaOH → Na3PO4 + +3Н2O Н3РО4(надл.) + NaOH → → NaН2PO4 + Н2O 3 К2СО3 + 2Н3РО4 → 2К3PO4 + + 3H2O + 3 CO2↑ t 2Н3РО4 → H4P2O7 + Н2O |
Взаємодія нітратної кислоти з металами
НNO3(розб.) N−3Н4NO3 N20 N+2O не взаємодіє
 |  |  |
Li … Mg Al Zn Cr Fe … Sn Pb H2 Cu … Ag Au Pt
 |  | ||||||
 | |||||||
 | |||||||
N2+1O N+4O2 не взаємодіє
НNO3(конц.)
на холоді не реагує – пасивується, внаслідок нагрівання:
Al + 6НNO3 → Al(NO3)3 + 3NO2↑ +3 Н2O
n
Me + НNO3 → Me(NO3)n + Н2O +?
Застосування нітратної кислоти
| Для виготов-лення барв-ників | Для одержан-ня пороху та інших вибу-хових речовин | Для розчинен-ня міді, свин-цю, срібла, які не реагують з іншими кисло-тами | Для виготовлення лікарських препаратів (стрептоцид) | Для одержання добрив |
Застосування ортофосфатної кислоти
| Для виробництва добрив | Для виготовлення кормових добавок | У харчовій промисловості (наприклад, для надання кислуватого присмаку безалкогольним напоям) |
Розклад нітратів
| 2KNO3 → 2KNO2 + O2↑ (нітрати лужних металів) Cu(NO3)2 → 2CuO + 4NO2 + O2↑ 2AgNO3 → 2Ag +2NO2 + O2↑ (нітрати благородних металів) |
Солі ортофосфатної кислоти (фосфати)
| первинні | вторинні | третинні |
| NaH2PO4 натрій дигідрогенфосфат | Na2HPO4 натрій гідрогенфосфат | Na3PO4 натрій фосфат |
Застосування нітратів та фосфатів
| Назва та формула солі | Застосування |
| натрій нітрат НNO3 | Як добриво (натрієва селітра); для виробництва вибухових речовин; у харчовій промисловості |
| натрій фосфат Na3PO4 | Для пом’якшення води; для видалення масла й жиру з одягу |
| натрій гідроген фосфат Na2HPO4 | У харчовій промисловості; у фармацевтичній промисловості |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 727; Нарушение авторских прав?; Мы поможем в написании вашей работы!