
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретична частина
Типи стійкості дисперсних систем. Стійкість дисперсної системи – це здатність її впродовж певного часу зберігати незмінними склад, дисперсність, концентрацію, рівномірний розподіл частинок дисперсної фази в дисперсійному середовищі та характер взаємодії між частинками.
Колоїдні частинки зазнають дії двох взаємно протилежних сил взаємодії – притягання та відштовхування. З одного боку, завдяки силам притягання відбувається злипання частинок, що перебувають у броунівському русі, та їх осідання під дією сили земного тяжіння. З іншого боку, сили дифузії та відштовхування протидіють зближенню частинок та їх об'єднанню, забезпечуючи рівномірний розподіл частинок у всьому об'ємі системи. Сили відштовхування визначаються електричною взаємодією між йонами подвійного електричного шару, що оточують кожну колоїдну частинку. Залежно від того, які сили переважають у певній системі, відбувається або коагуляція (переважання сил притягання), або збільшення стійкості (переважання сил відштовхування).
М. Пєсков (1920 р.) запропонував поняття про кінетичну та агрегативну стійкість колоїдів. Кінетична (седиментаційна) стійкість дисперсних систем виявляється у збереженні рівномірного розподілу частинок у всьому об'ємі системи, тобто у протидії силам тяжіння, які спричинюють осідання частинок (седиментацію). Основна умова кінетичної стійкості – це висока дисперсність і участь частинок дисперсної фази у броунівському русі. Саме грубодисперсні системи є кінетично нестійкими, на відміну від молекулярних систем. Кінетична стійкість колоїдів тим більша, чим менший розмір частинок. Вона збільшується і при підвищенні температури, оскільки збільшення енергії броунівського руху перешкоджає осіданню частинок.
Агрегативна стійкість дисперсних систем – це здатність системи протидіяти злипанню (агрегації) частинок і цим утримувати певний ступінь дисперсності. З огляду на це, термодинамічно стійкими є молекулярні ліофільні системи (розчини високомолекулярних та поверхнево-активних речовин), утворення яких відбувається самочинно і супроводжується зменшенням енергії Гіббса (∆G < 0). Ліофобні системи (золі, суспензії, емульсії) є принципово термодинамічно нестійкими системами, оскільки мають великий запас вільної поверхневої енергії (∆G > 0). Тому порушення агрегативної стійкості шляхом злипання частинок у крупніші агрегати (коагуляція) є термодинамічно вигідним і самочинним процесом, бо призводить до зменшення поверхні поділу фаз. Підвищення температури, з одного боку, збільшує кінетичну стійкість, а з іншого – сприяє частішим і ефективнішим зіткненням частинок, їх злипанню, тобто порушенню агрегативної стійкості.
Коагуляція – це процес зменшення дисперсності системи за рахунок укрупнення (злипання) частинок дисперсної фази. Спричинити коагуляцію гідрофобних золів може будь-який чинник, що порушує агрегативну стійкість системи: різка зміна температури (нагрівання або заморожування), інтенсивне струшування, перемішування, центрифугування, дія світла і різного типу випромінювань, електричних розрядів та особливо електролітів. Усі ці чинники або зменшують сили відштовхування, або збільшують сили притягання між колоїдними частинками. І найважливішим чинником коагуляції золів є дія електролітів. Останні дуже швидко і різко впливають на товщину подвійного електричного шару та на величину ζ-потенціалу, який є одним із головних чинників стійкості гідрофобних колоїдних систем.
Розглянемо основні закономірності коагуляції електролітами – правила коагуляції.
1. З помітною швидкістю коагуляція відбувається лише за певної кількості введеного електроліту. Мінімальну концентрацію електроліту в ммоль, яка здатна спричинити коагуляцію 1 дм3 золю, називають порогом коагуляції (γ) або критичною концентрацією (Ск).
Початок явної коагуляції колоїдних розчинів визначають за такими ознаками, як зміна їх забарвлення або поява каламуті. Поріг коагуляції обчислюють за формулою:
 (2.11)
(2.11)
де Сел – концентрація електроліту;Vел – об’єм електроліту;Vзолю – об’єм колоїдного розчину.
Величину, зворотну порогу коагуляції, називають коагулюючою здатністю. Коагулююча здатність Vк – це об’єм золю, скоагульованого одним молем електроліту. Початок коагуляції можна визначити за різними ознаками: за зміною забарвлення золю, виникненням каламуті. Початком виділення осаду і т. д.
2. Коагулюючу дію виявляє не вся молекула електроліту, а лише той його йон, знак якого протилежний до заряду гранули. Ці йони електроліту називають коагулюючими або йонами-коагуляторами. Така закономірність була встановлена М. Гарді 1900 року.
Процес коагуляції зумовлений тим, що збільшення концентрації йонів, що мають заряд, протилежний знаку потенціалвизначальних йонів, призводить до стиснення дифузної частини подвійного електричного шару і зменшення заряду гранули. При досягненні порогової концентрації електроліту електростатичні сили відштовхування між частинками слабшають, вони при наближенні об'єднуються у крупніші агрегати і випадають в осад. Мінімальне значення ζ-потенціалу, за якого золь стійкий, називають критичним потенціалом (30 мВ). За правилом Шульце, коагулююча здатність йона тим більша, чим більший його заряд. Тому найменший поріг коагуляції будуть мати електроліти, що містять багатозарядний йон-коагулятор.
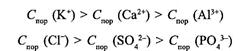 .
.
Поріг коагуляції є оберненим до заряду йона (z) в шостому степені:
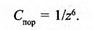
Тому значення порогів коагуляції для одно-, дво- і тризарядних йонів відносяться приблизно як:
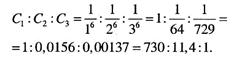
Отже, згідно з правилом Шульце–Гарді, чим вища валентність коагулюючого йона, тим нижчий поріг коагуляції і більша коагулююча здатність.
3. У неорганічних йонів (катіонів і аніонів) однакового заряду коагулююча активність зростає із зменшенням ступеня гідратації та збільшенням радіуса йона.
Li+ – Na+ – K+ – Rb+ – Cs+ – Fr+
F– – Cl– – Br– – NO3– – I– – SCN–
 зменшення ступеня гідратації, збільшення коагулюючої активності
зменшення ступеня гідратації, збільшення коагулюючої активності
Це пояснюється тим, що менш гідратований йон легше адсорбується і сильніше притягається зарядженою частинкою. Такі ряди йонів називають ліотропними, або рядами Гофмейстера.
4. Йони органічних сполук виявляють кращу коагулюючу активність порівняно з неорганічними. Це пояснюється тим, що органічні йони характеризуються великою специфічною адсорбційною здатністю і легше входять у внутрішню частину подвійного електричного шару колоїдних частинок. За правилом Траубе, у гомологічних рядах електролітів з органічними йонами коагулююча здатність рівномірно збільшується із зростанням довжини вуглеводневого залишку.
5. При коагуляції гідрофобних золів сумішами електролітів може спостерігатись одне з трьох явищ: адитивність, антагонізм або синергізм електролітів (рис.). Точки с1 і с2 є пороговими концентраціями кожного з двох електролітів у чистому вигляді. Адитивність (крива 1) виявляється у підсумовуванні коагулюючої здатності електролітів. Таке явище спостерігається,коли йони-коагулятори мають однаковий заряд і близький ступінь гідратації (суміш KNO3 і КС1 або NaCl і КС1).

|
| Рис. Спільна дія електролітів при коагуляції: 1 – адитивність; 2 – антагонізм; 3 – синергізм |
Антагонізм електролітів (крива 2) полягає в тому, що у коагулюючій суміші вміст кожного електроліту значно перевищує його власну порогову концентрацію. Г. Фрейндліх вважав, що причиною антагонізму є здатність одного йона зменшувати адсорбційну здатність, а тому і коагулюючу силу іншого йона. Антагонізм спостерігається при коагуляції золю AgІ сумішами Al(NO3)3 і K2SO4; Ti(NO3)4 і Na2SO4.
Синергізм (крива 3 ) – це посилення коагулюючої дії електроліту іншим, і тому для коагуляції золю суміші потрібно менше, ніж за правилом адитивності. Синергізм спостерігається при коагуляції золю HgS сумішшю LiCl і СаС12.
Гетерокоагуляція, взаємна коагуляція золів. Гетерокоагуляція – це агрегація частинок, що відрізняються за складом (або величиною). Одним із випадків гетерокоагуляції є взаємна коагуляція, яка відбувається при зливанні золів з протилежно зарядженими гранулами. За цих умов один із золів відіграє роль йона-коагулятора, який зменшує величину ζ-потенціалу іншого золю. Золі виявляють максимальний вплив, якщо сумарний заряд їх частинок дорівнює нулю.
Іноді коагуляція залежить від способу додавання електроліту-коагулятора. Якщо електроліт додавати невеликими порціями через певні проміжки часу, то коагуляція настає за більшої його сумарної концентрації, ніж за одноразового додавання. Це явище називають звиканням золів. Причиною звикання золів є підвищення заряду частинок внаслідок адсорбції йонів, заряджених однойменно з частинкою, або утворення пептизатора в результаті реакції золю з електролітом.
Якщо до колоїдних розчинів додати невелику кількість розчинів високомолекулярних або поверхнево-активних речовин, спостерігається явище колоїдного захисту, тобто значне підвищення стійкості золів. Воно проявляється у зниженні їх чутливості до дії електролітів або інших коагулюючих факторів. Механізм захисної дії зводиться до утворення навколо колоїдної частинки адсорбційної оболонки з BMP (ПАР), що підвищує її стійкість.
Здатність BMP (ПАР) захищати золі від коагуляції кількісно оцінюють захисним числом, яке дорівнює числу міліграмів сухої BMP (ПАР), що захищає 10 мл золю від коагуляції при додаванні до нього 1 мл 10 % розчину NaCl. Захисне число називають золотим, залізним та ін. у залежності від того, який золь приймають за стандарт.
Захисне число (S, г/л золю) розраховують за формулою:
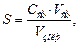
де С ст – концентрація розчину стабілізатора, г/л; V ст – об'єм розчину стабілізатора, необхідний для запобігання коагуляції золю, мл; V золю – об'єм золю, взятий для дослідження, мл.
|
|
Дата добавления: 2014-11-29; Просмотров: 2121; Нарушение авторских прав?; Мы поможем в написании вашей работы!