
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Високомолекулярні сполуки
|
|
|
|
Високомолекулярні сполуки (ВМС) – речовини складної хімічної будови з молекулярною масою від декількох тисяч до мільйона і більше вуглецевих одиниць (ВО). Білки і більшість природних сполук, а також синтетичні полімери є ВМС.
Знання специфіки розчинення ВМС та властивостей їх розчинів необхідні майбутньому фармацевту для правильного розуміння технології різних лікарських форм.
У фармацевтичній практиці розчини ВМС зустрічаються дуже часто: тваринні та рослинні білки, крохмаль та інші. Різноманітні комбінації ВМС зустрічаються в галенових препаратах (настойках, екстрактах), які вводяться в склад мікстур.
Багато ВМС та їх розчини застосовуються для стабілізації (захисту) лікувальних колоїдів, суспензій, емульсій.
BMС класифікують за різними ознаками. За походженням їх поділяють на природні і синтетичні. До природних належать білки (протеїни), вищі полісахариди (крохмаль, целюлоза), натуральний каучук.
Синтетичні BMС отримують у процесах полімеризації і поліконденсації. До них належать синтетичні каучуки (полібутадієн, поліхлоропрен та ін.) і різні синтетичні полімери (поліетилен, полівінілхлорид, поліаміди і т. д.).
Органічні BMС за складом головного ланцюга макромолекул розділяють на такі три групи:
1. Карболанцюгові BMС, основні полімерні ланцюги яких побудовані виключно з атомів вуглецю.
2. Гетероланцюгові BMС, полімерні ланцюги їх окрім атомів Карбону містять також гетероатоми (Оксигену, Нітрогену, Фосфору, Сульфуру та ін.).
3. Елементоорганічні BMС, вони містять у головних ланцюгах макромолекул атоми елементів, що не входять до складу природних органічних сполук – Сіліцію, Алюмінію, Титану, Плюмбуму, Стибію та ін.
|
|
|
Крім органічних існують також і неорганічні BMС. До них можна віднести одну з модифікацій сірки (пластична сірка).
За структурою полімерного ланцюга BMС розділяють на лінійні, розгалужені і просторові (сітчасті або тривимірні).
За формою макромолекул розрізняють глобулярні і фібрилярні BMС. У глобулярних макромолекулами є звернуті кульовидні утворення – глобули. Представники таких BMС – рослинний білок, кров'яні тільця. Під впливом зовнішніх дій глобулярні BMС можуть розвертатися і переходити у фібрилярну форму.
Фазові і фізичні стани ВМС. Усі полімери внаслідок великої молекулярної маси нелеткі. Вони розкладаються при перегонці навіть у найбільшому вакуумі. Температура їх розкладання значно нижча за температуру кипіння, що і пояснює неможливість переходу ВМС у газоподібний стан. З цієї причини для ВМС характерний тільки конденсований стан – твердий і рідкий. Твердому агрегатному стану полімеру відповідають два фазові стани: кристалічний і аморфний, що залежить від ступеня упорядкованості молекул. Кристалічними ВМС є, наприклад, поліетилен, поліаміди, а аморфними – целюлоза, каучуки.
Висока ступінь упорядкованості у полімерів може досягатись шляхом взаємної орієнтації ланцюгів при відсутності орієнтації ланок. При цьому полімер є двофазною системою, тобто в ньому співіснують кристалічна і аморфна фази.
Аморфні лінійні полімери в залежності від температури можуть бути у трьох фізичних станах: склоподібному, високоеластичному, в'язкотекучому.
Склоподібний стан характеризується наявністю коливального руху атомів, що входять до складу ланцюга, біля положення рівноваги. Високоеластичний стан характеризується наявністю коливального руху ланок, внаслідок якого ланцюг BMP набуває здатності вигинатися. В'язкотекучий стан характеризується рухливістю всієї макромолекули як єдиного цілого.
|
|
|
При нагріванні полімеру спочатку виявляється коливальний рух ланок і тільки при більш високій температурі – рух ланцюгів. Отже, при підвищенні температури аморфний лінійний полімер переходить із склоподібного у високоеластичний і потім у в'язкотекучий стан.
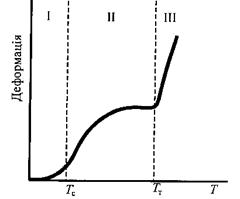 Рис. 3.1. Термомеханічна крива полімеру
Рис. 3.1. Термомеханічна крива полімеру
|
При зниженні температури полімер проходить всі три стани у зворотному порядку. Взаємні переходи цих станів супроводжуються зміною механічних властивостей полімеру і зображуються у вигляді термомеханічних кривих (рис. 3.1).
Термомеханічна крива має три ділянки, що відповідають трьом фізичним станам. Ділянка І відповідає стану, для якого характерні малі деформації – склоподібний стан, ділянка II високоеластичному стану, з великими оборотними деформаціями. При достатньо високих температурах відбувається переміщення ланцюгів як єдиного цілого, тобто істинна течія полімеру. Полімер переходить з високоеластичного стану  у в'язкотекучий. Цей перехід супроводжується різким збільшенням деформації (ділянка III).
у в'язкотекучий. Цей перехід супроводжується різким збільшенням деформації (ділянка III).
Середні температури областей переходу називаються температурами переходу. Температура переходу із склоподібного у високоеластичний стан (і навпаки) називається температурою склування Тс, температура переходу із високоеластичного у в'язкотекучий стан (і навпаки) – температурою текучості ТТ.
Розчини ВМС. Високомолекулярні сполуки мають здатність розчинятись у тому чи іншому розчиннику, утворюючи розчини ВМС, проте розчиняються вони значно повільніше за низькомолекулярні сполуки. При цьому залежно від спорідненості ВМС до розчинника можуть утворюватись як істинні, так і колоїдні розчини.
Процес розчинення високомолекулярних сполук за механізмом суттєво відрізняється від розчинення низькомолекулярних речовин. Початковим етапом розчинення ВМС є набрякання. Набрякання – це самочинний процес вбирання високомолекулярною речовиною великих кількостей низькомолекулярної рідини, що супроводжується значним збільшенням об'єму та маси ВМС.
На відміну від розчинення низькомолекулярних речовин, коли проходить дифузія розчиненої речовини у розчинник, у процесі розчинення ВМС відбувається в основному одностороння дифузія молекул розчинника у ВМС. Цьому сприяють два чинники: велика швидкість дифузії малих за розміром молекул розчинника і нещільне упакування гнучких ланцюгових макромолекул полімеру.
|
|
|
Розрізняють дві стадії набрякання. На першій стадії невелика кількість молекул розчинника дифундує у ВМС, вони заповнюють проміжки між макроланцюгами і сольватують певні групи ВМС. Стадія сольватації супроводжується виділенням теплоти (∆Н < 0), яку називають теплотою набрякання. Вимірюванням теплоти набрякання було доказано, що сольватний шар є мономолекулярним. У цьому шарі молекули розчинника розташовані компактно, що призводить до ущільнення системи в цілому, тобто до внутрішнього стиснення. Це виявляється у контракції – зменшенні об'єму системи в цілому (сума об'ємів полімеру до набрякання і поглинутої рідини є більшою за об'єм одержаної системи).
Таким чином, на першій стадії взаємодії ВМС з розчинником утворюється гетерогенна система, яка складається з дещо сольватованої ВМС і низькомолекулярного розчинника. Ця стадія характеризується зменшенням вільної енергії, в основному за рахунок зменшення ентальпії системи (∆Н < 0), бо ентропія майже не змінюється або може навіть зменшуватись (∆S = 0 або ∆S < 0). Проте ∆Н > TΔS, тому ∆G < 0.
Друга стадія набрякання, яка не супроводжується виділенням теплоти, характеризується значним збільшенням маси і об'єму полімеру внаслідок осмотичного всмоктування великої кількості розчинника. При цьому слабшають зв'язки між окремими макромолекулами, збільшується число їх можливих конформацій і відбувається змішування деякої кількості великих і гнучких макромолекул із молекулами розчинника. Розпушування сіток ВМС зменшує упорядкованість системи, тобто веде до зростання ентропії (∆S > 0). Таким чином, друга стадія характеризується такими рівняннями: ∆Н ~ 0; T∆S > 0; ∆G < 0. При цьому система є двофазною і складається з набряклого ВМС і розчину ВМС у низькомолекулярній рідині.
Якщо для ВМС характерне обмежене набрякання, то процес розчинення закінчується однією із стадій набрякання і веде до утворення еластичних драглів. Це спостерігатиметься тоді, коли між полімерними ланцюгами діють сильні міжмолекулярні зв'язки і енергії сольватації недостатньо для їх розриву. Обмежене набрякання характерне для вулканізованого каучуку в бензені і желатини у воді кімнатної температури.
|
|
|
Процес набрякання кількісно характеризується ступенем і швидкістю набрякання. Ступінь набрякання (α) виражається кількістю рідини, поглиненої одиницею маси або об'єму полімеру.
Ступінь набрякання може бути визначений ваговим або об'ємним методом. Ваговий метод полягає у зважуванні зразку до і після набрякання. Ступінь набрякання розраховується за формулою.
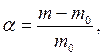
де m0 – маса вихідного полімеру; m – маса набряклого полімеру. Об'ємний метод визначення ступеня набрякання оснований на вимірюванні об'єму полімеру до і після набрякання:

де V0 – об'єм вихідного полімеру; V – об'єм набряклого полімеру.
Величину ступеня набрякання можна визначити лише у обмежено набрякаючих полімерів, бо при необмеженому набряканні зразок полімеру починає розчинятися і маса його зменшується.
 τ
Рис. 3.2. Кінетичні криві обмеженого (1) і необмеженого (2) набрякання полімеру
τ
Рис. 3.2. Кінетичні криві обмеженого (1) і необмеженого (2) набрякання полімеру
|
Ступінь набрякання змінюється в часі. Залежність α = f (τ) виражається кривою, що характеризує кінетику набрякання. На рис. 3.2 представлені кінетичні криві для обмеженого (крива 1) і необмеженого набрякання (крива 2). При обмеженому набряканні α досягає граничного (максимального) значення αmах, при необмеженому – крива проходить через максимум, після якого α падає до нуля в результаті поступового розчинення полімеру.
Швидкість набрякання полімеру визначається швидкістю дифузії розчинника в нього, тому вона характеризується тими ж закономірностями, що і хімічна реакція 1-го порядку. Отже, константу швидкості набрякання полімеру можна розрахувати за рівнянням:

де αmах – граничний або максимальний ступінь набрякання, α – ступінь набрякання до часу τ.
Осмотичний тиск ВМС. Рівняння Галлера. Наявність у розчинах ВМС відносно великих гнучких макромолекул суттєво впливає на осмотичний тиск розчинів полімерів. У зв'язку з малою концентрацією частинок в одиниці об'єму, осмотичний тиск розчинів ВМС навіть за досить великих концентрацій невеликий. Подібно до ступеня набрякання і в'язкості, осмотичний тиск має мінімальне значення при рН ізоелектричної точки і зростає при зміщенні рН в обидві сторони від неї. Залежить величина осмотичного тиску і від температури: з підвищенням температури він зростає за рахунок збільшення ступеня дисоціації йоногенних груп полімерів.
Величину осмотичного тиску розчинів ВМС обчислюють за рівнянням Галлера, яке порівняно з рівнянням Вант-Гоффа містить додатковий член, що враховує взаємодію між гнучкими макромолекулами полімеру між собою і з молекулами розчинника:

де С – концентрація ВМС, в г/л; М – середня молекулярна маса ВМС; b – константа, яка характеризує відхилення від закону Вант-Гоффа; вона зростає із збільшенням довжини макромолекули і розгалуженням ланцюга ВМС.
Поділивши ліву і праву частину вище приведеного рівняння Галлера на концентрацію С, одержимо вираз:

У такому вигляді вираз є рівнянням прямої, за допомогою якої графічно знаходять відносну середню молекулярну масу ВМС. Для цього вимірюють осмотичний тиск кількох розчинів ВМС різної масової концентрації і будують графік залежності π/С – С (рис. 3.3).
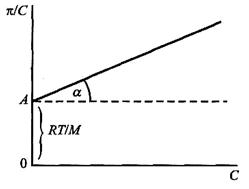 Рис. 3.3. Графік залежності π/С – С для розчину ВМС
Рис. 3.3. Графік залежності π/С – С для розчину ВМС
|
Відрізок 0А, який відсікає пряма від початку координат, дорівнює (RT)/M, а тангенс нахилу прямої до осі абсцис дає константу b (b = tg a). Середню молекулярну масу ВМС обчислюють за формулою М = RT/ОА. Осмометричним методом визначають середню молекулярну масу ВМС у межах від 20 тис. до 1 млн а. о. м.
В’язкість розчинів ВМС. Одна із важливих особливостей розчинів полімерів полягає в тому, що їх в'язкість значно більша за в'язкість розчинів низькомолекулярних речовин.
Розчини BMС з анізометричними частинками не підпорядковуються основним законам в'язкої течії (законам Ньютона і Пуазейля), виявляючи так звану аномальну в'язкість. В'язкість їх завжди дуже велика (навіть для дуже розбавлених розчинів) і залежить від діючої сили. При цьому в'язкість розчину зменшується із збільшенням тиску, під яким відбувається течія рідини. В більш концентрованих розчинах полімерів під дією міжмолекулярних сил зчеплення утворюються просторові структурні сітки, які збільшують в'язкість розчину. При підвищенні тиску структурні сітки руйнуються і в'язкість розчинів падає, доки вся структура не зруйнується. Після цього розчин тече, підпорядковуючись законам Ньютона і Пуазейля. Отже, концентровані розчини BMС мають структурну в'язкість.
Фізичною причиною в'язкості є сили внутрішнього тертя, які діють між прилеглими шарами рідини під час її витікання.
Закони в'язкості. Ламінарна течія характерна для чистих рідин, розчинів низькомолекулярних речовин, деяких колоїдів і дуже розведених розчинів ВМС. Її характеризують двома основними законами: постулатом Ньютона та законом Пуазейля.
Згідно з постулатом Ньютона, сила в'язкого опору рідини (сила тертя F) пропорційна градієнту швидкості течії (dυ/dx) і площі контакту рухомих шарів (S):
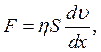
де η – коефіцієнт в'язкості або в'язкість.
Якщо S = 1 м2, dυ = 1 м/с, dx = 1 м, то F = η. Таким чином, в'язкість дорівнює силі опору між шарами рідини площею 1 м2, що знаходяться на відстані 1 м один від одного, за градієнта швидкості течії, що дорівнює одиниці.
Розмірність в'язкості у міжнародній системі одиниць – Па∙с.
Закон Пуазейля визначає об'єм рідини, в'язкість якої η, що витікає за час τ крізь капіляр з радіусом r і довжиною l за зовнішнього тиску р:

За умов ламінарної течії в'язкість є сталою і не залежить від зовнішньої сили або тиску, який спричинює течію. При переході від ламінарної течії до турбулентної в'язкість перестає бути сталою для даної рідини і вже не підлягає закону Ньютона.
В'язкість розчинів BMС залежить від концентрації розчину. Штаудінгер показав, що для розбавлених розчинів полімерів з жорсткими молекулами питома в'язкість розчину описується рівнянням:
ηпит = К∙М∙с,
де К – константа для даного полімергомологічного ряду в даному розчиннику; М – молекулярна маса полімеру; с – масова концентрація розчину полімеру. При цьому
 ,
,
де ηо, η – в'язкість розчинника і розчину відповідно.
З приведеного рівняння випливає, що приведена в'язкість (ηпр) дорівнює:

Але для більшості розчинів полімерів приведена в'язкість лінійно зростає із збільшенням концентрації. Відрізок, що відсікається прямою на осі ηпр, називається характеристичною в'язкістю [η].
Характеристична в'язкість – це граничне значення приведеної в'язкості розчину при концентрації, що прямує до нуля:
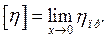
Характеристична в'язкість залежить лише від природи полімеру і не залежить від його концентрації.
Залежність характеристичної в'язкості від природи полімеру описується узагальненим рівнянням Штаудінгера. Його також називають рівнянням Марка–Куна–Хаувінка:

де М – молекулярна маса полімеру; К і α – коефіцієнти, сталі для даного гомологічного ряду полімеру і розчинника. Величина α характеризує форму макромолекул в розчині і пов'язана з гнучкістю їх ланцюгів. Значення α міститься в межах 0,5–1,0. Для жорстких макромолекул α = 1.
В наш час узагальнене рівняння Штаудінгера використовують для визначення молекулярної маси полімеру. Експериментально в'язкість рідин визначають у приладах – віскозиметрах.
У концентрованих розчинах BMС макромолекули можуть взаємодіяти одна з одною і утворюються так звані асоціати. Із збільшенням концентрації розчинів або із зниженням температури розмір і тривалість існування асоціатів збільшується. Асоціати робляться настільки великими і міцними, що їх можна розглядати як нову фазу. Виділення цієї фази у вигляді найдрібніших крапель призводить до розшарування системи, сам процес виділення називається коацервацією, а двофазна система – коацерватом.
Явище коацервації використовується в фармації при мікрокапсулюванні з метою захисту лікарських речовин від дії навколишнього середовища.
Розчини BMС при певних умовах втрачають свою текучість, тобто перетворюються у драглі.
Драглі і процес драглювання мають велике значення в медицині, біології, тому що організми тварин і рослин в основному складаються з драглів. Драглі знаходять широке застосування у фармації для створення перспективних лікарських форм. Властивості їх можна регулювати зміною концентрації інградієнтів або за допомогою речовин, що зшивають макромолекули. Лікарські форми у вигляді драглів можна виготовити м'якими, щільними, навіть хрящуватими.
Причиною драглювання розчинів BMС є виникнення зв'язків між макромолекулами, в результаті чого в системі з'являється просторова сітка. Якщо зв'язки між макромолекулами не дуже міцні, то механічна дія (перемішування, струшування) може зруйнувати структуру і драглі перейдуть у рідину. При усуненні цієї дії розчини BMС знову самодовільно драглюються.
Підвищення температури перешкоджає драглюванню, (зменшується число і тривалість контактів макромолекул), і навпаки. Драглюванню розчинів завжди сприяє підвищення концентрації, бо підвищується частота зіткнень між макромолекулами.
На здатність до драглювання водних розчинів поліамфолітів (наприкдад, білків) впливає рН розчину. Драглювання краще відбувається в ізоелектричному стані.
Із властивостей драглів слід відзначити такі:
1. Тиксотропія. Багато драглів під впливом механічних дій (перемішування, струшування) можуть переходити в розчини, а потім після зупинення дії знову драглюватися.
Руйнування драглів і утворення їх знову називається тиксотропією. Як правило, тиксотропні перетворення можуть бути повторені з одними й тими ж драглями необмежену кількість разів. Таким чином, тиксотропію можна розглядати як оборотний ізотермічний процес драглі ↔ розчин.
2. Синерезис. Свіжоприготовані драглі BMС при стоянні часто зазнають зміни: об'єм їх зменшується, відбувається агрегація частинок, на поверхні драглів з'являються краплини рідини, розмір і число яких поступово збільшуються. В результаті утворюються дві макрофази – рідка і драглеподібна, яка зберігає форму посудини. Цей процес називають синерезисом. Рідка фаза, яка виділяється при синерезисі, не є чистим розчинником, а представляє собою розчин BMС меншої концентрації.
Причиною синерезису є те, що при утворенні драглів система ще не досягла стану рівноваги і в ній продовжуються процеси утворення нових зв'язків між макромолекулами.
В фармації при виготовленні лікарських форм з використанням концентрованих розчинів BMС слід враховувати можливість синерезису.
3. Дифузія. Дифузія низькомолекулярних речовин у розбавлених драглях (95–99 % води) відбувається з такою ж швидкістю, як у воді, і підпорядковується закону Фіка.
Для більшості концентрованих драглів на дифузію впливає ряд факторів, таких, як структура і концентрація драглів, ступінь дисперсності і природа частинок дифундуючої речовини.
Залежність швидкості дифузії від концентрації драглів пов'язана з тим, що при зростанні концентрації збільшується щільність структурної сітки, зменшуються розміри комірок, заповнених розчинником, отже утруднюється проникнення через драглі дифундуючих частинок.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 12104; Нарушение авторских прав?; Мы поможем в написании вашей работы!