
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
План уроку. 1.Поняття ідеального газу, як фізичної ідеалізації
|
|
|
|
1.Поняття ідеального газу, як фізичної ідеалізації
2.Умови за яких гази можна вважати ідеальними
3.Рівняння стану ідеального газу. Дослідна перевірка його
1.Поняття ідеального газу, як фізичної ідеалізації
З трьох агрегатних станів, в яких може перебувати речовина, найбільш простим для вивчення є газоподібний. Тому вивчення властивостей речовин ми починаємо саме з властивостей газів. У розрідженого газу відстань між молекулами у багато разів перевищує їхні розміри. У цьому випадку взаємодія між молекулами є дуже малою і кінетична енергія руху молекул значно перевищує потенціальну енергію їх взаємодії. Молекули газу можна розглядати як маленькі тверді кульки. Замість реального газу ми будемо розглядати його фізичну модель, нехтуючи складними силами взаємодії між молекулами і полегшуючи тим самим вивчення властивостей газів. Ця модель називається ідеальним газом.
Ідеальний газ — це газ, взаємодією між молекулами у якому можна знехтувати.
2.Умови за яких гази можна вважати ідеальними
Газами, властивості яких близькі до властивостей ідеального газу, є реальні гази, що перебувають під низьким тиском чи мають високу температуру. Наприклад, повітря за нормальних умов (105 Па і 0 °С) можна наближено вважати ідеальним газом.
Газ можна вважати ідеальним, якщо:
1) відсутні сили міжмолекулярної взаємодії, тобто молекули не притягаються і не відштовхуються;
2) взаємодія між молекулами відбувається тільки під час їх зіткнень і є пружною;
3) молекули газу не мають об'єму і вважаються матеріальними точками.
Слід пам'ятати, що у фізичній моделі беруть до уваги ті властивості реальної системи, урахування яких необхідно для пояснення закономірностей поведінки системи, що досліджуються.
|
|
|
3.Рівняння стану ідеального газу. Дослідна перевірка його
Рівняння, яке пов’язує всі ці параметри за сталої маси газу, називається рівнянням стану ідеального газу: 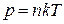 ,
,  ,
, 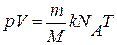 .
.
Добуток сталої Больцмана k і сталої Авогадро NА називають універсальною газовою сталою R: 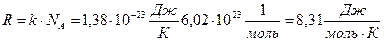

Якщо індексом 1 визначити параметри, які належать до першого стану, а індексом 2 — ті, що стосуються другого параметру газу, то для даної маси газу:
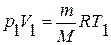 ,
, 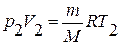 ;
;  ,
, 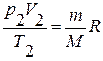
Права частина цих рівнянь однакова, тобто однакова й ліва частина:
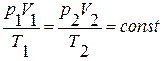
Дане рівняння називається рівнянням Клапейрона (на честь французького фізика Б. Клапейрона) і є однією з форм запису рівняння стану.
Рівняння ж стану ідеального газу отримано російським вченим Д. І. Менделєєвим, тому згодом його назвали рівнянням Менделєєва — Клапейрона.
Знаючи рівняння стану ідеального газу, можна визначити:
1) третій параметр газу, якщо відомі два;
2) перебіг у системі різних процесів за певних зовнішніх умов (наприклад, як за незмінної температури змінюватиметься тиск газу, якщо збільшувати його об’єм);
3) як змінюється стан системи, якщо вона виконує роботу чи отримує тепло від навколишніх тіл.
Розв’язування задач
1. Під водою на глибині h= 5,0 м відломали нижній кінець запаяної скляної трубки, і в неї увійшло m = 1,95 г води. Яким був тиск р0 в запаяній трубці? Обєм трубки V = 2,0 см3, атмосферний тиск р=105Па.
2.Відкриту з двох сторін скляну трубку завдовжки l = 1,0 м наполовину занурюють у ртуть. Потім трубку закривають зверху і виймають. Якої довжини х стовпчик ртуті в трубці залишиться? Атмосферний тиск Н=750мм рт. ст.
3. В центрі відкачаної і запаяної з обох кінців горизонтальної трубки довжиною L = 1,0 м знаходиться стовпчик ртуті довжиною Н= 20 см.
Якщо трубку поставити вертикально, стовпчик ртуті зміститься на l =10 см До якогось тиску р0 була відкачана трубка?
|
|
|
4. Горизонтальну циліндричну посудину розділили на дві частини тонким металевим поршнем. Одна частина посудини містить кисень, інша - такої ж за маси кількість водню. Як зрівноважити поршень, якщо довжина судини l = 50 см?
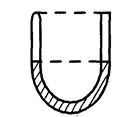
5. У лівому, запаяному коліні U-подібної трубки (див. малюнок) знаходиться стовп повітря заввишки h1 = 30 см. Ртуть в обох колінах знаходиться на одному рівні. Якою буде висота h2 стовпа повітря у лівому коліні, якщо в праве долити ртуттю доверху? Атмосферний тиск Н = 760 мм рт. ст.
Домашнє завдання:
1.Герметично закритий посуд повністю заповнений водою за тимпературі t = 27°С. Яким став б тиск р усередині посудини, якщо сили взаємодії між молекулами води раптово зникли?
2.В посудину з ртуттю опускають відкриту з двох сторін скляну трубку, залишаючи над поверхнею її частину довжиною l = 60 см. Потім трубку закривають і занурюють ще на а = 30 см. Визначте висоту h стовпа повітря в трубці, якщо атмосферний тиск дорівнює Н=760 мм рт. ст.
Тема уроку: Ізопроцеси в газах. Газові закони
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1027; Нарушение авторских прав?; Мы поможем в написании вашей работы!