
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
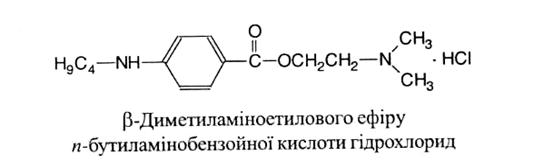
Tetracaini hydrocloridum 1 страница
|
|
|
|
Властивості. Білий кристалічний порошок без запаху. Легко розчинний у воді та спирті, важко розчинний у хлороформі, практично нерозчинний у ефірі.
Ідентифікація.
1. Реакція на вторинну аміногрупу після лужного гідролізу:
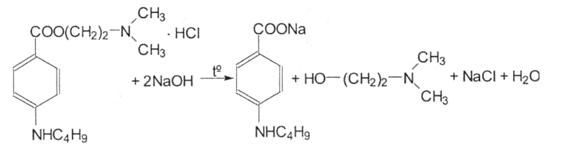
При підкисленні випадає білий осад п-бутиламінобензойної кислоти, який розчиняється в надлишку кислоти хлористоводневої:

Під дією натрію нітриту випадає осад N-нітрозосполуки ціє кислоти:

2.Субстанція дає реакції на хлориди.
3. Нітрування дикаїну з подальшим утворенням калієвої солі ацинітроформи орто-хіноїдної будови криваво-червоного кольору:
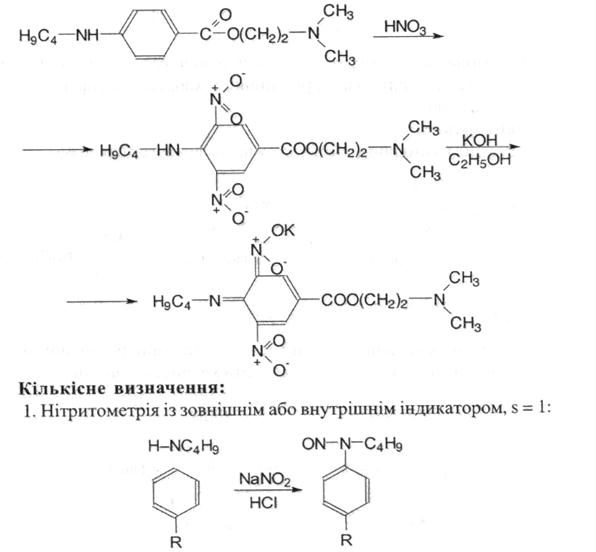
2. Алкаліметрія за зв’язаною кислотою хлористоводневою, s = 1.
3. Аргентометрія за зв’язаною кислотою хлористоводневою, s = 1.
Зберігання. У добре укупореній тарі, що вберігає від дії світла.
Застосування. Місцевоанестезуючий засіб. Дикаїн за силою дії перевищує новокаїн, але більш токсичний: за кокаїн – у 2 рази і за новокаїн – у 10 разів.
ЛЕКЦІЯ № 14
Тема: Лікарські засоби - похідні гетероциклічних сполук.
ПЛАН
10. Загальна характеристика гетероциклічних сполук.
11. Похідні фурану: нітрофурал (фурацилін), фурасемід.
12. Похідні піразолу: анальгін.
13. Похідні піролу: пірацетам.
14. Похідні піридину: ізоніазид, фтивазид.
Гетероциклічні сполуки- це органічні речовини, що містять цикли, до складу яких крім атомів карбону входять один або декілька атомів інших елементів – гетероатомів (нітрогену, оксигену та сульфуру).
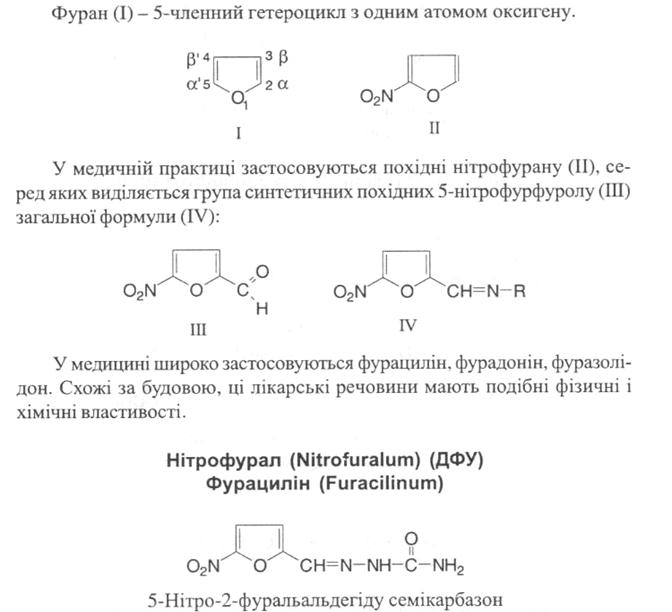
Отримання: Вихідною речовиною для синтезу фурациліну є фурфурол.
Похідні фурану – ацидофобні речовини, тому для нітрування фурфуролу застосовують на нітратну кислоту, а ацетилнітрат або суміш нітратної кислоти і піридину.
|
|
|
Властивості: кристалічний порошок жовтого або коричнювато – жовтого кольору, дуже мало розчинний у воді (1:4200), в присутності натрію хлориду розчинність збільшується, мало розчинний у 96% спирті, практично не розчинний в ефірі, розчинний у розчинах лугів.
Ідентифікація:
1. За фізико-хімічними показниками. УФ та ІЧ- спектроскопія, тонкошарова хроматографія.
2. При розчиненні субстанції в диметилформаміді і подальшому додаванні розчину калію гідроксиду спиртового з’являється фіолетово-червоне забарвлення:

3. При розчиненні наважки субстанції в суміші рівних об’ємів води і розчину лугу з’являється помаранчево-червоне забарвлення утвореної солі ацинітроформи.
4. Нагріванні одержаного лужного розчину нітрофуралу призводить до виділення аміаку, який виявляють за запахом або посинінням вологого червоного лакмусового папірця:

Кількісне визначення:
1. Спектрофотометрія (метод стандарту при λ = 375 нм) ДФУ
2. Йодометрія в лужному середовищі, зворотне титрування, індикатор крохмаль, s = ½. Наважку препарату розчиняють у присутності натрію хлориду у воді у мірній колбі при нагріванні на водяному огрівнику. До визначеної кількості розчину додають надлишок титрованого розчину йоду та розчин лугу. Відбувається окисно-відновна реакція:

3.Фотоколориметрія, визначення оптичної густини забарвленого лужного розчину фурациліну.
Зберігання. У добре укупорених склянках із темного скла, у прохолодному захищеному від світла місці.
Застосування. Антибактеріальний засіб, діє на грампозитивні та грамнегативні мікроорганізми. Зовнішньо для лікування та попередження гнійно-запальних процесів та внутрішньо для лікування бактеріальної дизентерії.

Лікарські засоби – похідні піразолу.
У медицині застосовуються як анальгетики, протизапальні та жарознижуючі засоби похідні піразоліну та піразолідину:
|
|
|

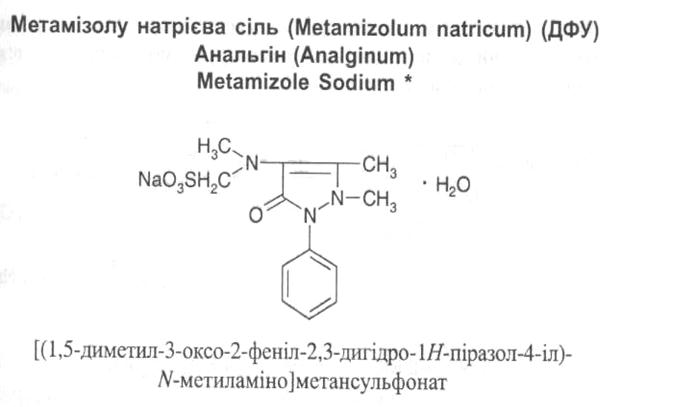
Властивості: кристалічний порошок білого або майже білого кольору. У присутності вологи розкладається. Водні розчини при стоянні жовтіють, дуже легко розчинний у воді, розчинний у 96% спирті.
Ідентифікація:
1. ІЧ- спектроскопія.
2. Субстанція з розчином перекису водню концентрованого дає синє забарвлення, яке швидко зникає і через декілька хвилин переходить в інтенсивно-червоне. З іншими окисниками (хлорид заліза, хлорне вапно, нітратна концентрована кислота) анальгін також утворює забарвлені продукти окиснення.
3. Підкислений розчин субстанції обережно нагрівають. Пробірку накривають фільтрувальним папером, змоченим розчином калію йодиду та розчином крохмалю. Пари оксиду сульфуру, що виділяються, забарвлюють фільтрувальний папір у синій колір. Формальдегід, що виділяється, з розчином натрієвої солі хромотропової кислоти у кислоті сірчаній дає синьо-фіолетове забарвлення:
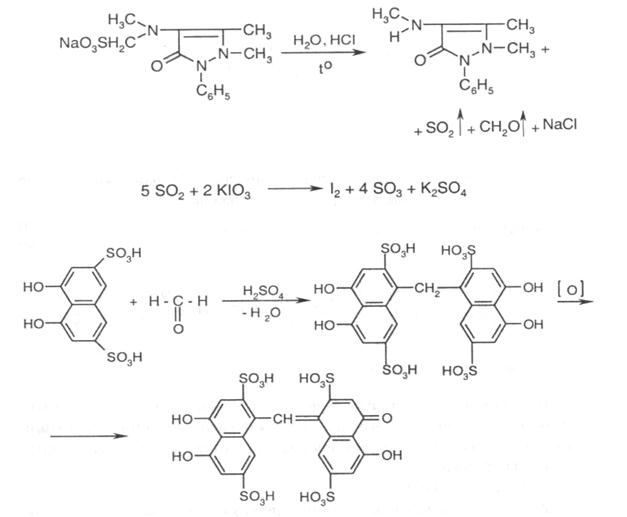
4. Субстанція дає реакції на натрій.
5. Підкислений спиртовий розчин субстанції при додаванні розчину калію йодату забарвлюється в малиновий колір (проміжні продукти окиснення), а при подальшому додаванні реактиву забарвлення посилюється і виділяється бурий осад йоду.
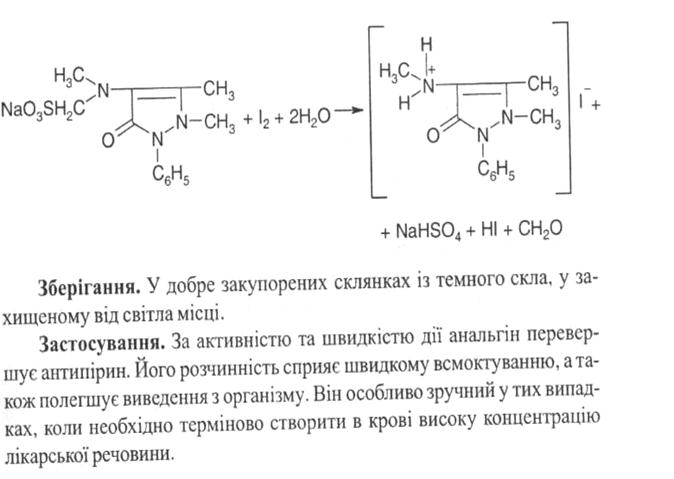
Кількісне визначення. Йодометрія (ДФУ), пряме титрування, індикатор крохмаль, s = 1. Підкислений розчин субстанції титрують розчином йоду до появи блакитного забарвлення, що не зникає протягом двох хвилин:

Властивості: білий кристалічний порошок, легко розчинний у воді й етанолі, мало розчинний у хлороформі.
Ідентифікація:
1. ІЧ- спектроскопія.
2. Відсутність виражених максимумів поглинання в УФ – спектрі 1% водного розчину в інтервалі 230-250 нм.
3. Виділення аміаку при нагріванні з розчином натрію гідроксиду:

2.Визначення азоту в органічних сполуках.
Зберігання. У сухому, захищеному від світла місці.
Застосування. Психотропний (ноотропний)засіб.
Лікарські засоби – похідні піридину.
До лікарських речовин цієї групи належать похідні піридинкарбонових кислот – ніктинової та ізонікотинової.
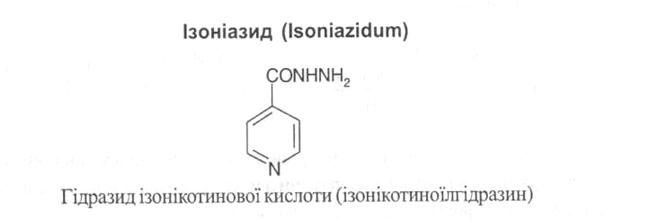
Властивості. Білий кристалічний порошок без запаху, гіркий на смак, легко розчинний у воді, важко- у спирті, малорозчинний у хлороформі.
Ідентифікація:
|
|
|
1. По фізико-хімічним показникам: температура плавлення, ІЧ – спектроскопія.
2. Визначення температури плавлення гідразону (осад жовтого кольору), отриманого при взаємодії з ваніліном.
3. З розчином міді сульфату утворюється блакитне забарвлення і осад, які при нагріванні набувають світло-зеленого кольору, виділяються бульбашки газу:
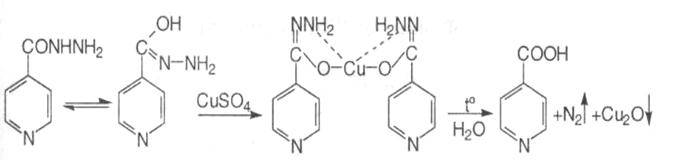
4. З аміачним розчином срібла нітрату ізоніазід утворює спочатку жовтуватий осад, потім наліт металічного срібла на стінках пробірки:
5.Субстанція дає реакції на піридиновий цикл. При кип’ятінні з 2,4- динітрохлорбензолом утворюється жовте забарвлення, яке від додавання розчину лугу переходить у фіолетове, а потім в бурувато-червоне.
Кількісне визначення:
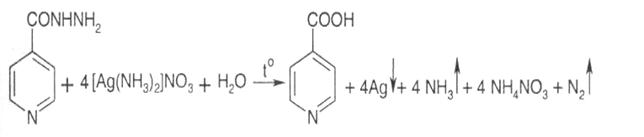
1. Броматометрія, пряме титрування, індикатор – метиловий червоний, s = 1,5. Метод грунтується на окисненні субстанції бромом:

2. Йодометрія в присутності натрію гідрокарбонату, зворотне титрування, індикатор крохмаль, s = ½:

Властивості: світло-жовтий дрібнокристалічний порошок із слабким запахом ваніліну, без смаку, дуже мало розчинний у воді, мало розчиннний у 96% спирті, легко розчинний у кислотах і розчинах лугів.
Ідентифікація:
1.Після нагрівання з 2,4- динітрохлорбензолом і додавання лугу утворюється жовтувато-буре забарвлення, що з часом посилюється.
2. При додаванні розчину лугу до спиртового розчину фтивазиду світло-жовте забарвлення переходить у оранжево-жовте. При поступовому додаванні кислоти хлороводневої розчин стає знову жовтим, а потім оранжево-жовтим (підтвердження амфотерних властивостей фтивазиду).
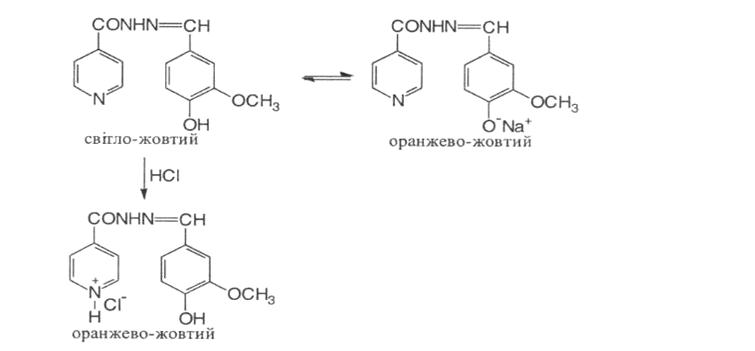
3. При нагріванні фтивазиду з кислотою хлороводневою відчувається запах ваніліну:

Кількісне визначення: Ацидиметрія в неводному середовищі, індикатор – кристалічний фіолетовий. Итрування ведуть до переходу червоно – коричневого забарвлення в сіро – зелене, оскільки солі фтивазиду мають оранжево-жовтий колір, s = 1:

Паралельно проводять контрольний дослід (перехід забарвлення від фіолетового до синього).
Зберігання. У добре укупореній тарі.
|
|
|
Застосування. Протитуберкульозний засіб.
ЛЕКЦІЯ № 15
Тема: Лікарські засоби групи алкалоїдів.
ПЛАН
1. Загальна характеристика алкалоїдів.
2. Класифікація.
3. Загальноалкалоїдні, групові і спеціальні реактиви на алкалоїди.
4. Методи кількісного визначення алкалоїдів.
5. Похідні тропану: атропіну сульфат.
6. Похідні імідазолу: пілокарпіну гідрохлорид.
7. Похідні бензолізохіноліну і фенантренізохіноліну: папаверину гідрохлорид, морфіну гідрохлорид, етилморфіну гідрохлорид, кодеїн, кодеїну фосфат.
8. Похідні пурину: кофеїн, кофеїн- бензоат натрію, теобромін, теофілін.
Початок 19 сторіччя ознаменувався відкриттям лікарських засобів рослинного походження – алкалоїдів: морфіну – в 1806 році, кофеїну – в 1819 році, хініну -1820 році, атропіну – 1833.
Алкалоїди – це органічні речовини, головним чином рослинного походження, основного характеру із-зі наявності в молекулі азоту (alkali - луг, eidos - подібний).
Алкалоїди мають складну хімічну будову, маючи в основі різноманітні гетероциклічні ядра: піролідин, піридин, хінолін, ізохінолін, індол, імідазол, пурин та ін. Найбільш багаті на алкалоїди рослин сімейства Рapaveraceae, Ranunculaceae, leguminosae.
Рослини, що містять алкалоїди, використовувались людиною з давніх давен як у лікувальних, так і в рекреаційних цілях. Так, в Месопотамії лікарські рослини були відомі вже за 2000 років до н. е. В «Одисеї» Гомера згадується подаровані Олені єгипетською царицею ліки, що дарують «забуття бід». Вважається, що мова йшла про засіб із вмістом опію. В I—III віках до н. е. в Китаї написана «Книга домашніх рослин», в якій згадувалось медичне використання ефедри і опійного маку. Листя коки використовувались індіанцями Південної Америки також с давніх часів.
Екстракти рослин, що містять отруйні алкалоїди, такі як аконітин і тубокурарин, використовувалсиь для виготовлення отруйних стріл.
Вивчення алкалоїдов почалось в XIX ст. В 1804 році німецкий аптекар Фрідріх Сертюрнер лив із опіуму «снодійний принцип» (лат. principium somniferum), який назвав «морфієм» в честь Морфея, древнєгрецького бога снів (сучасна назва «морфін» належить французському фізику Гей-Люссаку).
Значний внесок у хімію алкалоїдов внесли французські дослідники Пьєр Пеллетье и Жозеф Каванту, які відкрили зокрема, хінін (1820) і стрихнін (1818). Протягом наступних десятиріч виделені ксантин (1817), атропін (1819), кофеїн (1820), коніін (1827), нікотин (1828), колхіцин (1833), спартеїн (1851), кокаїн (1860) і інші алкалоїди.
Повний синтез алкалоїда впеше здійснений в 1886 р. для конііну німецким хіміком Альбертом Ладенбургом шляхом взаємодії 2-метилпіридину с ацетальдегідом і відновлення отриманого 2-пропенілпіридину за допомогою натрію.
Поява в XX ст. спектроскопії и хроматографії стала поштовхом до прискореного розвитку хімії алкалоїдов. таном на 2008 рік відомо більше 12000 алкалоїдов.
Фізичні властивості: більшість алкалоїдів - тверді кристалічні речовини, без кольору, без запаху, гіркого смаку. Оптично активні.
Алкалоїди – основи мало або нерозчинні у воді, добре розчиняються в органічних розчинниках (спирті, хлороформі, ефірі, бензолі). Алкалоїди – солі навпаки. Виключенням є кофеїн, нікотин, ефедрин, пілокарпін, які досить добре розчиняються у воді.
Для виділення алкалоїдів з рослинної сировини використовують такі методи:
1. Виділення у вигляді солей.
2. Виділення у вигляді основ.
Більшість рослин містять не один, а декілька алкалоїдів. Розділення виділеної суми алкалоїдів проводять методами:
1. Дробної перегонки у вакуумі.
2. За різною розчинністю алкалоїдів - солей та основ.
3. За різною силою основності алкалоїдів.
4. За особливостями хімічних властивостей.
5. За різною здатністю до адсорбції (хроматографічні методи).
6. Метод протиточного розподілення.
Для ідентифікації алкалоїдів використовують загальні (групові) і специфічні реакції. Загальні реакції проводяться із загальноалкалоїдними осаджувальними і спеціальними реактивами. Ці реакції основані на утворенні простих або комплексних солей з різноманітними кислотами, солями важких металів, комплексними йодидами та ін. Продукти взаємодії, як правило, нерозчинні у воді, тому реактиви називають осаджувальними.
Загальноалкалоїдні осаджувальні реактиви:
•Реактив Люголя, Вагнера, Бушарда (розчини йоду в калію йодиді різної концентрації).
•Реактив Драгендорфа (розчин вісмуту йодиду в калію йодиді).
•Реактив Майєра (розчин ртуті йодиду в калію йодиді).
•Реактив Марме (розчин кадмію йодиду в калію йодиді).
•Реактив Зоннештейна – фосфорно-молібденова кислота
H3PO4. 12MO3. 2H2O - дуже чутливий реактив на алкалоїди. Він дає аморфні осади жовтуватого кольору, які через деякий час набувають синього або зеленого забарвлення (відновлення молібденової кислоти).
•Реактив Шейблера – фосфорно- вольфрамова кислота
H3PO4. 12WO3. 2H2O.
•Реактив Бертрана – кремній – вольфрамова кислота
SiO2. 12WO3. 4H2O.
•Свіжовиготовлений 5% розчин таніну.
•Насичений розчин пікринової кислоти.
Для алкалоїдів характерні кольорові реакції із спеціальними реактивами, в основі яких лежать хімічні реакції: відщеплення води, окиснення, конденсації з альдегідами в присутності водовіднімаючих речовин.
Спеціальні реактиви.
· Концентрована сірчана кислота.
· Концентрована азотна кислота.
· Реактив Ердмана (суміш концентрованих сірчаної і азотної кислот).
· Реактив Фреде (розчин амонію молібдату в кислоті сірчаній концентрованій).
· Реактив Маркі (розчин формальдегіду в кислоті сірчаній концентрованій).
· Реактив Вазіцкі (розчин п-диметиламінобензальдегіду у кислоті сірчаній концентрованій).
Для кількісного визначення алкалоїдів використовують:
7) Метод ацидиметрії в неводному середовищі – для кількісного визначення як солей, так і основ.
8) Методи кислотно-основного титрування:
· Ацидиметрія, пряме титрування основ кислотами;
· Зворотна ацидиметрія – визначення основ зворотним титруванням;
· Алкаліметрія – титрування солей алкалоїдів лугом у водноспиртовому середовищі в присутності фенолфталеїну (з використанням або без використання органічного розчинника, який не змішується з водою, для екстракції основи алкалоїда);
· Алкаліметрія за замісником.
9) Гравіметричний метод.
10) Методи, основані на індивідуальних хімічних властивостях алкалоїдів.
11) Фізико-хімічні методи.
Класифікація алкалоїдів.
Спочатку алкалоїди класифікувались по ботанічним ознакам, пізніше визнана найбільш доцільною хімічна класифікація, в основу якої покладено будову скелета молекули алкалоїда:
-Алкалоїди – похідні хінолізину і хінолізидину


Алкалоїди – похідні тропану
Алкалоїди – похідні тропану містяться в рослинах сімейства пасленових (беладона, дурман, блекота).
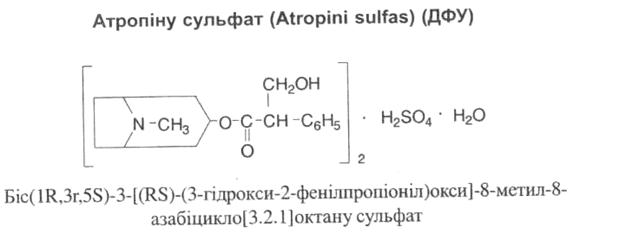
Атропін вперше виділено в 1833 році з беладони. У самій рослині міститься лівообертаючий ізомер – гіосціамін і лише сліди атропіну. Атропін утворюється з гіосціаміну в результаті рацемізації при температурі 114-116ºС, при більш високій температурі утворюється апоатропін, який не має фармакологічних властивостей атропіну.
Властивості: білий кристалічний порошок, дуже легко розчинний у воді, легко розчинний у спирті, практично нерозчинний у ефірі. Плавиться при 190ºС.
Ідентифікація:
1. За фізико-хімічними константами: ІЧ-спектроскопія, оптичне обертання.
2. За температурою топлення пікрату атропіну.
3. Реакція Віталі-Морена на тропову кислоту. До субстанції у порцеляновій чашці додають кислоту азотну димлячу, випаровують досуха – утворюється нітросполука жовтого кольору, яку розчиняють у ацетоні і додають спиртовий розчин калію гідроксиду – з’являється фіолетове забарвлення:

4. Субстанція дає реакції на сульфати.

5. Субстанція дає загальноалкалоїдну реакцію з реактивом Драгендорфа (розчин вісмуту йодиду в калію йодиді) в кислому середовищі, утворюється оранжево-червоний осад.
6. Визначають температуру топлення основи атропіну (115-117ºС) після осадження розчином аміаку.
7. Утворення бензальдегіду (запах гіркого мигдалю) при нагріванні атропіну з кислотою сірчаною концентрованою в присутності кристалика калію дихромату:
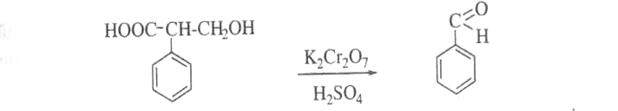
Кількісне визначення:
1. Ацидиметрія в неводному середовищі, пряме титрування з потенціометричним фіксуванням точки еківалентності, s=1:
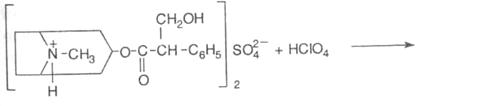

2. Акаліметрія в спирто-хлороформному середовищі, s =1/2.
3. Фотоколориметрія за реакцією з пікриновою кислотою.
Зберігання: у добре закупореній тарі.
Застосування: холінолітичний (спазмолітичний, мідріатичний)засіб.
Алкалоїди – похідні бензолізохіноліну

Вперше виділений з опію.
Властивості: білий кристалічний порошок, помірно розчинний у воді, мало розчинний у96% спирті.
Ідентифікація:
1.За фізико-хімічними константами: УФ-спектроскопія.
2.За температурою топлення основи папаверину після осадження розчином аміаку.
3.Після нагрівання субстанції з оцтовим ангідридом та кислотою сульфатною розчин забарвлюється у жовтий колір з зеленою флуоресценцією.
4.Субстанція дає реакцію на хлориди.
5.З концентрованою азотною кислотою утворюється жовте забарвлення, що переходить у оранжеве при нагріванні (реакцію проводять у порцеляновій чашці.)
6.З концентрованою сірчаною кислотою при нагріванні утворюється фіолетове забарвлення.
7.З реактивом Маркі спочатку утворюється червоне забарвлення, потім жовте і яскраво-оранжеве. Під дією бромної води та аміаку з’являється фіолетовий осад, який розчиняється у спирті і дає фіолетово-червоне забарвлення.
Кількісне визначення:
1.Алкаліметрія в суміші спирту та 0,01 М розчину кислоти хлористоводневої з потенціометричним фіксуванням точки еквівалентності, s=1 (ДФУ).
2.Ацидиметрія в неводному середовищі, пряме титрування в присутності ацетату ртуті, s = 1.
3.Алкаліметрія у водно-спиртовому середовищі без використання хлороформу, бо папаверин дуже слабка основа, s = 1.
4.Спектрофотометрія (у лікарських формах).
Зберігання: у добре закупореній тарі що захищає від світла.
Застосування: спазмолітичний засіб.
Алкалоїди – похідні фенантренізохіноліну
Містяться в опії – висушеному молочному соку, що виділяється з надрізів головок снодійного маку. Суміш гідрохлоридів алкалоїдів опію застосовується під назвою омнопон.

Властивості: білі голчасті кристали або білий кристалічний порошок, що жовтіє при зберіганні, повільно розчинний у воді, важко розчинний у 96% спирті, дуже мало розчинний в хлороформі та ефірі.
Ідентифікація:
-Субстанція дає реакцію на хлориди.
-З реактивом Фреде – фіолетове забарвлення, що переходить у синє, при стоянні – в зелене.
-При додаванні до розчину субстанції аміаку виділяється білий кристалічний осад, що розчиняється в розчині натрію гідроксиду (внаслідок утворення натрієвої солі по фенольному гідроксилу).
-З реактивом Маркі – пурпурове забарвлення, що швидко переходить у синьо- фіолетове (відмінність від кодеїну).
-Питоме обертання від -97º до - 99º (2% водний розчин).
-З розчином хлориду заліза - синє забарвлення (реакція на фенольний гідроксил).
-З солями діазонію утворює азобарвник.
-Реакція окиснення калію гексаціанофератом у кислому середовищі з утворенням оксидиморфіну. При подальшому додаванні до реакційної суміші розчину хлориду заліза утворюється «берлінська блакить» - синє забарвлення:
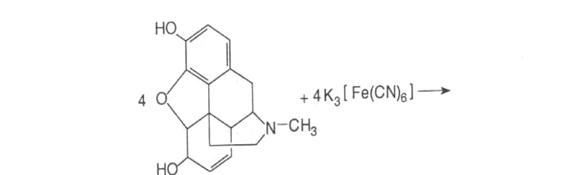

-При взаємодії з кислотами сірчаною або хлористоводневою концентрованими утворюється апоморфін, який від додавання кислоти азотної концентрованої набуває інтенсивно – червоного забарвлення.
Кількісне визначення:
1. Ацидиметрія в неводному середовищі, пряме титрування в присутності ацетату ртуті, індикатор кристалічний фіолетовий,
s = 1.
2. Аргентометрія по методу Фольгарда, s = 1.
3.Алкаліметрія у хлороформно-спиртовому середовищі, s = 1.
Зберігання: у добре укупореній тарі темного скла в захищеному від світла місці.
Застосування: анальгетичний (наркотичний) засіб.
Пролонгованим препаратом морфіну є морфілонг – 0,5% розчин морфіну гідрохлориду в 30% водному розчині полівінілпіролідону.
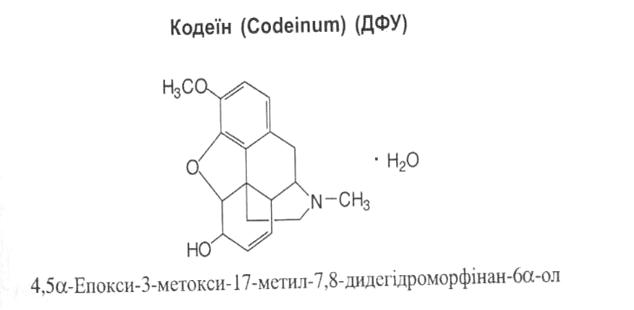
Властивості: білий кристалічний порошок розчинний у киплячій воді, легко розчинний у 96% спирті, розчинний в ефірі.
Ідентифікація:
1. За фізико-хімічними константами: УФ та ІЧ-спектроскопія, температура топлення.
2. При нагріванні з концентрованою сірчаною кислотою та заліза хлоридом з’являється синє забарвлення, яке переходить у червоне при додаванні однієї краплі кислоти азотної розведеної.
3. З реактивом Маркі синьо- фіолетове забарвлення, яке посилюється при стоянні.
4. З концентрованою азотною кислотою оранжеве забарвлення.
Кількісне визначення:
1. Ацидиметрія в неводному середовищі (ДФУ). Наважку субстанції розчиняють в суміші кислоти оцтової безводної та діоксану, титрують розчином кислоти хлорної, індикатор кристалічний фіолетовий, s = 1.
2. Як основу визначають методом ацидиметрії у водно-спиртовому середовищі, індикатор – метиловий червоний, s = 1.
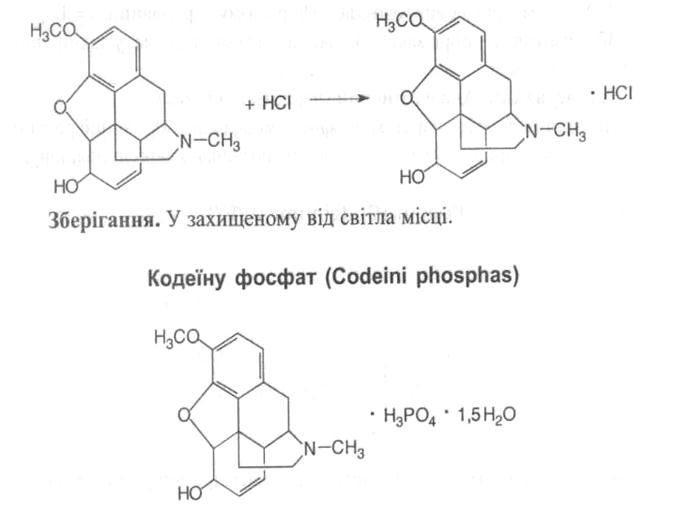
Властивості: білий кристалічний порошок без запаху, гіркий на смак, на повітрі вивітрюється, легко розчинний у воді, мало розчинний у 96% спирті, дуже мало розчинний в хлороформі та ефірі.
Ідентифікація:
-Дає ті ж реакції, що і кодеїн.
-Крім того:
· Реакція на фосфати з розчином срібла нітрату по випадінню жовтого осаду;
· За температурою топлення основи кодеїну, виділеного під дією розчину натрію гідроксиду (154-157ºС).
Кількісне визначення:
1. Ацидиметрія в неводному середовищі, s = 1.
2. Алкаліметрія у хлороформно-спиртовому середовищі, індикатор фенолфталеїн, s = 1/2.

Властивості: білий кристалічний порошок, розчинний у воді і
96% спирті, практично не розчинний у ефірі.
Ідентифікація:
1. За фізико-хімічними константами: ІЧ-спектроскопія.
2. За температурою топлення основи етилморфіну, виділеного під дією розчину натрію гідроксиду.
3. При нагріванні субстанції з кислотою сірчаною концентрованою та розчином заліза хлориду з’являється блакитне забарвлення, що переходить у червоне після додавання кислоти нітратної концентрованої.
4. Субстанція дає реакцію на хлориди.
5. Йодоформна проба. При нагріванні до кипіння суміші субстанції, кристалічного йоду та розчину натрію гідроксиду з’являється характерний запах йодоформу:
6. З кислотою азотною концентрованою – оранжеве забарвлення.
7. УФ – спектроскопія.
Кількісне визначення:
1. Ацидиметрія в неводному середовищі, в присутності ацетату ртуті, з потенціометричним фіксуванням точки еквівалентності s = 1.
2. Алкаліметрія у водно-спиртовому середовищі з додаванням хлороформу, індикатор фенолфталеїн, s = 1.
Зберігання: у добре укупореній тарі темного скла в захищеному від світла місці.
Застосування: анальгетичний (наркотичний) і протикашльовий засіб.
Для лікування очей як протизапальний засіб.
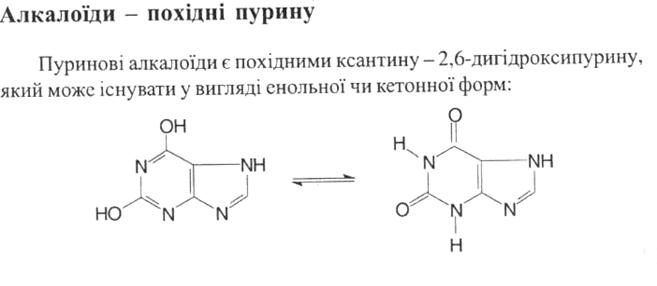
У медичній практиці застосовують кофеїн, теофілін і теобромін, а також подвійні солі – кофеїн-бензоат натрію та еуфілін, які відрізняються кращою розчинністю у воді, ніж відповідні алкалоїди.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 3549; Нарушение авторских прав?; Мы поможем в написании вашей работы!