
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: Тепловий рух. Внутрішня енергія тіла і способи її зміни. Кількість теплоти. Питома теплоємність речовини. Робота в термодинаміці. Закони термодинаміки
|
|
|
|
МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Задачі для практичної роботи
Значення теплового розширення тіл в природі і техніці.
Розширення тіл при нагріванні і стиснення при охолодженні в природі грають величезну роль. Нерівномірний прогрів повітря у поверхні Землі створює конвекційні потоки (вітер), що обумовлюють зміну погоди. Нерівномірний прогрів води в морях і океанах створює течії, що роблять вплив на клімат прибережних країн.
Особливо різкі коливання температури відбуваються в гірських місцевостях. Це приводить до почергового розширення і стиснення гірських порід. Оскільки такі зміни об'єму залежать від роду речовини, то в гірських породах, що мають складний склад, виникають тріщини, які поступово збільшуються, тобто відбувається руйнування цих порід.
В побуті і техніці залежність густини речовини, довжини і об'єму тіл від температури теж має дуже велике значення. Залежність густини повітря від температури використовується в квартирах для рівномірного розподілу тепла, що виділяється печами і радіаторами, в печах — для створення тяги, в холодильниках — для рівномірного охолоджування камери і т.д.
В різного роду автоматичних пристроях використовуються біметалічні пластинки. Така пластинка складається з двох різнорідних металевих смуг, склепаних один з одним. При нагріванні біметалічної пластинки одна смуга подовжується більше за іншу і вся пластинка згинається контакт на біметалічних пластинках при нагріванні розмикається. Такі пластинки використовуються для автоматичного замикання і розмикання електричних ланцюгів в термостатах, в холодильниках, в протипожежних пристроях і т.п.
Залежність довжини від температури доводиться враховувати при натягуванні дротів на лініях електропередач, пристрої паропроводів, споруді мостів, прокладці рейок і т.д.
|
|
|
Для отримання спаїв металу з склом, наприклад при виготовленні електричних ламп і радіоламп, використовуються метали і стекла з близькими коефіцієнтами розширення.
1. Мідна лінійка при температурі 0ОС має довжину 1м. На скільки зміниться її довжина при підвищенні її температури до 35 ОС? При зниженні температури до -25ОС?
2. Довжин алюмінієвої лінійки при температурі 0ОС становить 79,5 см, а довжина стальної лінійки при тій же температурі 80см. При якій температурі їх довжини стануть однаковими?
Термодинаміка - розділ молекулярної фізики, який вивчає теплові процеси без вияснення внутрішніх чинників структури речовини.
Термодинаміка була створена в середині ХІХ століття. Після відкриття закону збереження енергії. В її основі лежить поняття внутрішньої енергії U. У середині ХІХ століття. було доведено, що поряд з механічною енергією макроскопічні тіла мають ще й енергію всередині цих тіл. Ця внутрішня енергія входить до балансу енергетичних перетворень у природі. Після відкриття внутрішньої енергії був сформульований закон збереження і перетворення енергії в теплових процесах, у результаті якого внутрішня енергія може переходити в механічну і навпаки. З погляду МКТ речовини внутрішня енергія макроскопічного тіла термодинамічної системи дорівнює сумі кінетичних енергій неперервного теплового руху всіх молекул (атомів) відносно центра мас тіла і потенціальних енергій взаємодії всіх молекул одна з одною. Обчислити U, враховуючи мікропараметри майже неможливо, тому для її вираження використовують макропараметри термодинамічної системи.
Найбільш простий за властивостями - одноатомний газ. До одноатомних можна віднести інертні гази: гелій, неон, аргон та ін. Обчислимо внутрішню енергію одноатомного ідеального газу. Оскільки молекули цього газу одна з одною не взаємодіють, то потенціальна енергія Е п = 0. Уся внутрішня енергія складається із кінетичної енергії руху Ек. За формулою Больцмана для одного атома 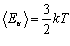 . А оскільки кількість атомів дорівнює
. А оскільки кількість атомів дорівнює 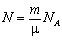 , то внутрішня енергія одноатомного ідеального газу
, то внутрішня енергія одноатомного ідеального газу 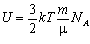 , де kNA = R. Остаточно маємо
, де kNA = R. Остаточно маємо
|
|
|

де m - маса всього газу; m - молярна маса; R - універсальна газова стала; T - термодинамічна температура; p - тиск газу; V - об'єм газу.
Внутрішня енергія ідеального одноатомного газу пропорційна температурі і не залежить від об'єму та інших макропараметрів. Зміна внутрішньої енергії маси ідеального газу відбувається тільки у разі зміни його температури T:
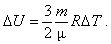
Якщо газ не одноатомний, то його молекули рухаються не тільки поступально, а й обертаються. Внутрішня енергія таких газів дорівнює сумі енергій поступального і обертального рухів.
У реальних газах, рідинах і твердих тілах середня потенціальна енергія взаємодії молекул не дорівнює нулю, тому їх внутрішня енергія залежить від об'єму речовини поряд з температурою.
Внутрішню енергію термодинамічної системи можна змінити двома способами:
1) виконанням роботи;
2) теплопередачею.
Теплопередачею або теплообміном називають процес передачі енергії від одного тіла до іншого без виконання роботи. Теплопередача може відбуватися такими способами:
1) теплопровідність;
2) випромінювання;
3) конвекція (перемішування).
Кількісну міру зміни внутрішньої енергії тіла під час теплообміну називають кількістю теплоти Q. У процесі теплообміну на межі між тілами відбувається взаємодія "повільних" молекул холодного тіла і "швидких" гарячого. У результаті кінетичні енергії молекул вирівнюються і швидкість молекул холодного тіла підвищується, а гарячого - знижується. Кількістю теплоти також називають енергію, яку гаряче тіло передає холодному в результаті теплообміну.
Кількісні вимірювання під час теплообміну виконують за допомогою калориметра, показаного на рис.3.2.2, на якому 1 - зовнішня посудина (корпус калориметра); 2 - внутрішня металева посудина (найкраще мідна, оскільки мідь - один з найкращих провідників теплоти; цю посудину ще називають власне калориметр); 3 - шар повітря; 4 - теплоізолювальна кришка; 5 - термометр; 6 - теплоізолювальні опори. Усередині калориметра зазвичай вміщують мішалку для перемішування рідини.
|
|
|
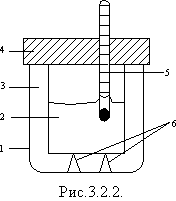
Наявність шару повітря між посудинами, теплоізолювальною кришкою і опорами утруднює всі види теплопередачі між тілами у внутрішній посудині і зовнішнім середовищем.
Якщо теплота передана тілу в результаті нагрівання чи охолодження, то експериментально встановлено, що
Q = cm (T 2 - T 1),
де c - коефіцієнт пропорційності, скалярна фізична величина, що називається питомою теплоємністю і яка чисельно дорівнює кількості теплоти, що відбирається або надається 1 кг речовини у разі зміни її температури на 1К:
c = Q, якщо m = 1 кг, T 2 - T 1 = D T = 1 К.
Внутрішня енергія тіла підвищується, коли воно отримує певну кількість теплоти від інших тіл, які його оточують (T 2 > T 1). У цьому разі Q > 0 і D U. Якщо ж тіло віддає певну кількість теплоти тілам (холоднішим від нього), які його оточують (T 2 < T 1), його внутрішня енергія зменшується: Q = D U < 0.
Одиниця кількості теплоти в СІ - джоуль: [ Q ] = Дж. Позасистемна одиниця кількості теплоти - калорія (кал). Калорію визначають як кількість теплоти, яку необхідно передати одному граму води, щоб збільшити його температуру на один градус Цельсія. 1 кал = 4,18 Дж.
Питому теплоту в СІ вимірюють в джоулях на кілограм на кельвін: 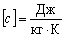 .
.
Для води 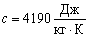 . Це досить велике значення питомої теплоємності, тому змінити температуру певної маси води досить важко. З цієї причини воду використовують як теплоносій у системах опалення. Велика теплоємність води зумовлює зменшення різких перепадів температури біля поверхні Землі, яка на 2/3 покрита водою.
. Це досить велике значення питомої теплоємності, тому змінити температуру певної маси води досить важко. З цієї причини воду використовують як теплоносій у системах опалення. Велика теплоємність води зумовлює зменшення різких перепадів температури біля поверхні Землі, яка на 2/3 покрита водою.
Питома теплоємність визначена для всіх тіл і залежить не тільки від властивостей речовини, але й від того, за яких умов здійснюється теплопередача. Наприклад, для нагрівання газу на 1 К при p = const треба передати більшу кількість теплоти Q, ніж для нагрівання при V = const.
Розглянемо інший спосіб зміни внутрішньої енергії термодинамічної системи -виконанням роботи. Виконання роботи в термодинаміці пов'язане зі зміною об'єму термодинамічної системи. Розрахуємо роботу А, яку виконує ідеальний газ внаслідок його ізобарного нагрівання. Будемо вважати, що газ знаходиться під невагомим поршнем площею S, який рухається уздовж циліндра без тертя (рис.3.2.3). Оскільки поршень не закріплений, то тиск газу p є сталим і наближено дорівнює атмосферному. Під час нагрівання на D T відбувається ізобарне розширення газу і його об'єм збільшується на D V = S D h, де S - площа поршня; D h - висота підняття поршня. Оскільки з механіки відомо, що 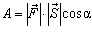 , де
, де 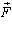 - сила, що діє на тіло, яке здійснює переміщення
- сила, що діє на тіло, яке здійснює переміщення 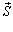 , то з урахуванням рівностей F = pS, a = 0°, |
, то з урахуванням рівностей F = pS, a = 0°, | 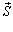 | = D h знаходимо:
| = D h знаходимо:
|
|
|
A = pS D h = p D V, (3.2.1)
де D V - зміна об'єму газу: D V = V 2 - V 1.
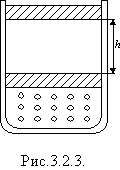
Формула (3.2.1) справедлива не тільки для ізобарного процесу, але і для будь-якого процесу, під час якого об'єм газу змінюється на досить малу величину D V.
Якщо в циліндрі під поршнем (рис.3.2.3) знаходиться 1 моль ідеального газу, то робота під час його ізобарного нагрівання
A = p D V m. (3.2.2)
Із рівняння Клапейрона-Менделеєва pV m = RT маємо  ,отже:
,отже:

Підставивши у (3.2.2) вираз (3.2.3) отримаємо:
A m = R D T. (3.2.4)
Із рівняння (3.2.4) при D T = 1 К R = A m. Таким чином можна сформулювати фізичний зміст універсальної газової сталої: універсальна газова стала R чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу під час нагрівання його на 1 К.
Якщо процес ізобарного розширення газу зобразити в координатах p, V, то можна помітити, що для обчислення роботи газу достатньо визначити площу фігури під графіком в цих координатах (рис. 3.2.4). Робота дорівнює площі фігури під графіком і для інших процесів, якщо вони зображені в координатах p, V, оскільки можна замінити, наприклад, реальний ізотермічний процес уявним ізобарним процесом, усереднюючи тиск (рис.3.2.5).
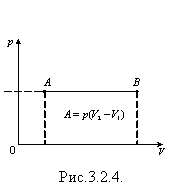
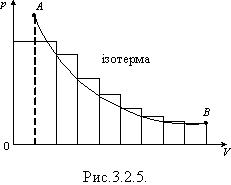
Під час ізохорного процесу A = 0. Розширюючись, газ виконує додатню роботу A > 0, оскільки напрям сили і напрям переміщення поршня збігаються.
У процесі розширення газ передає енергію оточуючим тілам. Якщо газ стискається, то формула для роботи газу така ж сама, але V 2 < V 1, тому A < 0.
Робота А, яка виконується зовнішніми тілами над газом, відрізняється від роботи газу тільки знаком, тобто A = - A' (A - робота над газом, A' - робота, яку виконує газ). Це викликано різними напрямами сили F і переміщенням поршня. Отже, робота зовнішніх сил, що діють на газ A' = - p D V. Під час стиснення газу, коли D V < 0, A' > 0, зовнішні тіла, здійснюючи над газом додатну роботу, передають йому частину своєї енергії.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1977; Нарушение авторских прав?; Мы поможем в написании вашей работы!