
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пептидная связь. Структура пептидной связи
|
|
|
|
Химические свойства аминокислот
Так как аминокислоты имеют в своем составе как кислотную, так и основную группы, они способны реагировать и с кислотами, и с основаниями, т. е., можно сказать, что аминокислоты являются амфотерными органическими соединениями.
Химические свойства аминокислот определяются их радикалами:
реакции солеобразования протекают по аминной и карбоксильной группам;
реакции окисления-восстановления – по – SH- и -S-S- группам;
реакции алкилирования (взаимодействия с гидроксильными группами спиртов) и ацилирования по NH2-, OH - и COOH -группам;
реакция фофорилирования - по OH -группам.
В определенных условиях (например, при воздействии определенных ферментов), аминокислоты способны реагировать друг с другом. В результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислотывозникает пептидная связь.
Образование пептидной связи можно представить себе, как отщепление молекулы воды от присоединяющихся к друг другу карбоксильной и аминогрупп (Рис. 1.9):
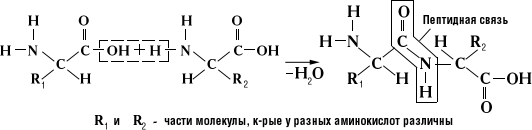
Рис. 1.9 Образование пептидной с вязи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм, что является средним значением между истинной одинарной связью C-N (0.149 нм) и истинной двойной связью C = N (0,127 нм). По некоторым данным, пептидная связь является частично двойной и частично одинарной:

Рис 1.10. Пептидная связь
Пептидная связь имеет плоскую структуру (планарная связь), т. е. все четыре атома (C, N, O, H) лежат в одной плоскости, и характеризуется определённой жёсткостью, т. е..
Эти свойства пептидной связи обеспечиваются так называемой sp2-гибридизацией электронов N и С' атомов, отсутствием вращения вокруг C´-N связи
|
|
|
Давайте более подробно остановимся на тонкой (электронной) структуре пептидной связи.
Электронные формулы C, N и O:
Углерод, азот и кислород относятся ко 2-му периоду, т. е. имеют два энергетических уровня. На втором (внешнем) энергетическом уровне локализованы два энергетических подуровня: s и p. Электронные формулы этих элементов имеют следующий вид:
Углерод C 1s2 2s2 2p2
Азот N 1s2 2s2 2p3
Кислород O 1s2 2s2 2p4
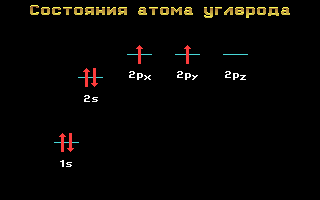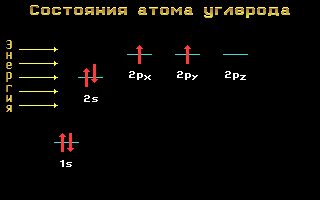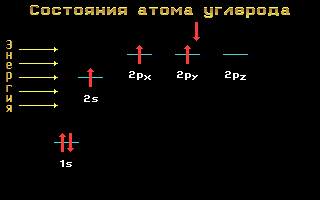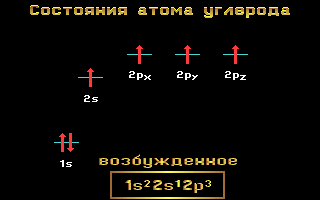
Рис. 1.11 Энергетические уровни атома углерода
Образованию ковалентной пептидной связи предшествует sp2-гибридизация атомных орбит атомов углерода и азота.
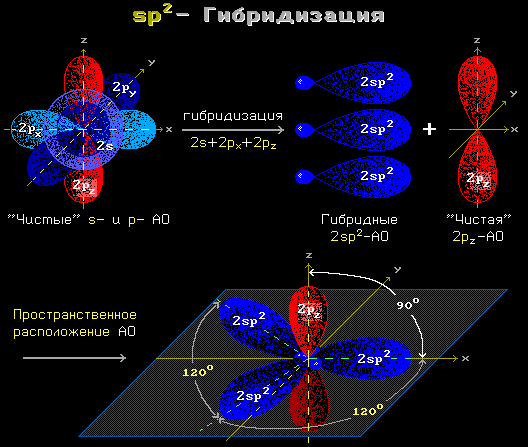
Рис. 1.12 sp2 гибридизация
sp2-гибридизация преобразует одну сферическую s- и две вытянутые p-орбиты электронов атома в три sp2-орбиты. Эти три орбиты вовлекают атом в три ковалентные связи, лежащие в одной плоскости.
Вовлеченные в sp2-гибридизацию электроны ковалентно связанных C' и N атомов создают "делокализованное" электронное облако, охватывающее оба эти атома, и распространяющиеся также — через связь С-О — на атом О (именно поэтому связи C'=N и C=O рисуются как равноправные "полуторные").
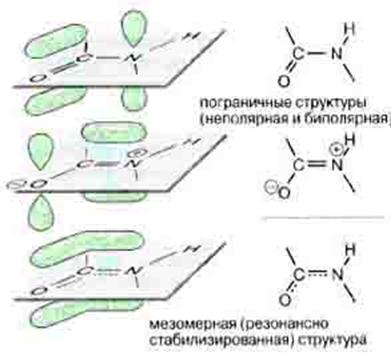
Рис. 1.13 Делокализация ковалентной связи при образовании пептидной связи
Ковалентная связь считается локализованной, если ее электронная пара находится в поле двух ядер и связывает только два атома.
Делокализованная связь – связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов. Такая делокализация (рассредоточение) электронов характерна для сопряженных π-связей, т.е. кратных связей, чередующихся с одинарными.
Рассредоточение электронов – энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы. Необходимым условием делокализации р-электронов является π-перекрывание р-атомных орбиталей соседних sp2-атомов.
|
|
|
Однако у C и N атомов есть еще p-электроны кроме тех, что уже задействованных в sp2 орбитах. И так как эти p-орбиты имеют форму "восьмерок", перпендикулярных всем трем sp2-орбитам, то дополнительная связь этих p-электронов — связь, требующая сближения "восьмерочных" орбит и "обобществления" (т.е. переходов с атома на атом) находящихся на них электронов, - это обобществление p-электронов препятствует вращению вокруг С'-N связи.
Атом кислорода карбоксильной группы и атом водорода аминогруппы могут находятся в цис - или транс -положении относительно связи –C-N-.

Рис. 1.14 Цис - и транс -форма пептидной связи
Экспериментально доказана большая устойчивость транс -формы.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1215; Нарушение авторских прав?; Мы поможем в написании вашей работы!