
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Йонно-електронний метод
|
|
|
|
Для складання рівнянь окисно-відновних реакцій застосовують також йонно-електронний метод.
1. Рівняння реакції записують йонно-електронними напівреакціями:



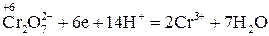 6 1 – відновлення, окисник
6 1 – відновлення, окисник 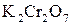 ;
;
6 (23)
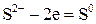 2 3 – окиснення, відновник
2 3 – окиснення, відновник 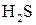 ;
;

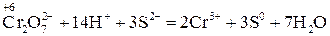 .
.
Перше рівняння відновлення біхромат іона показує, що під час перетворення йона  на катіон
на катіон 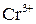 сім атомів Оксигену повинні зв'язуватися з 14 йонами Гідрогену (кисле середовище), утворюючи 7 молекул води.
сім атомів Оксигену повинні зв'язуватися з 14 йонами Гідрогену (кисле середовище), утворюючи 7 молекул води.
Друге рівняння процесу окиснення Сірки показує, що цей процес відбувається без участі йонів Гідрогену.
2. Знайшовши спільний множник (6) для цих двох йонно-електронних рівнянь і помноживши кожне з них на відповідні коефіцієнти (1 та 3), дістають сумарне йонне рівняння даної окисно-відновної реакції. Вірність сумарного рівняння перевіряють за тими ж ознаками, що і в методі електронного балансу, тільки напослідок перевіряють не суму ступенів окиснення, а суму зарядів йонів у обох частинах: (2−) + (14+) + 3(2−) = 2(3+) + 3(0) → (6+) = (6+).
3. Знайдені коефіцієнти переносять у вихідне молекулярне рівняння, а потім згідно з методом електронного балансу визначають число молекул H2SO4 (4) та H2O (7):
K2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + 3S + K2SO4 + 7H2O. (24)
Контрольні питання та завдання
1. На чому базується метод електронного балансу?
2. Назвіть послідовність дій під час визначення коефіцієнтів у рівняннях окисно-відновних реакцій методом електронного балансу.
3. У чому особливість деяких міжмолекулярних реакцій, у яких окисник або відновник одночасно є і середовищем?
3. ОКИСНИКИ І ВІДНОВНИКИ
Окисно-відновну здатність елементів якісно можна оцінювати за їх положенням у періодичній системі Д.І. Менделєєва, величинами енергії іонізації та електронегативності. Необхідно знати, що згідно з окисно-відновною функцією елементи розподіляють на три групи:
|
|
|
– тільки відновники;
– тільки окисники;
– окисники або відновники залежно від умов.
3.1. Відновники
Тільки відновниками можуть бути:
– вільні атоми металів усіх сімейств: s, р, d, f;
– хімічні сполуки, що містять неметалеві елементи головних підгруп
ІV–VІІ груп у формі існування з найбільш негативним ступенем окиснення:
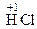 ,
, 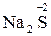 ,
, 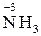 ,
, 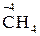 та ін.
та ін.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 763; Нарушение авторских прав?; Мы поможем в написании вашей работы!