
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основное титрование
|
|
|
|
ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
РАСЧЕТЫ РЕЗУЛЬТАТОВ
Способы титрования
Расчеты результатов анализа зависят от способов титрования. Различают методы прямого титрования, обратного и по заместителю.
В методе прямого титрования к некоторому объему анализируемого вещества (V х) непосредственно добавляют титрант с известной молярной концентрацией эквивалента (СТ). Определив объем титранта (VТ) в т. э., рассчитывают молярную концентрацию эквивалента (С х) или количество молей эквивалента анализируемого вещества (n х) по закону эквивалентов:
С х ∙ V х = СТ ∙ VТ;
n х = nТ;
n х = СТ ∙ VТ.
Массу определяемого вещества (m x) рассчитывают по формуле
m x = n х ∙ M(1/ ZX) ∙ cТ ∙ VТ ∙ M(1/ ZX),
где M(1/ Z X) – молярная масса эквивалента определяемого вещества.
Метод обратного титрования заключается в прибавлении к раствору анализируемого вещества избытка точно известного количества стандартного раствора В и после завершения реакции между ними титровании оставшееся количество вещества В раствором титранта С. Количество молей эквивалента определяемого вещества равно разности между количеством молей эквивалента веществ В и С:
n х = nВ – nС.
В методе титрования по заместителю к определяемому веществу добавляют реагент, вступающий с ним в реакцию. Затем один из продуктов взаимодействия (В) оттитровывают титрантом С. Количество молей эквивалента определяемого вещества при титровании заместителя всегда равно количеству молей эквивалента титранта:
n х = nВ = nС.
Пример 16 поможет Вам при решении задач №149, 150, 153–160, 164–166, 169–171.
Пример 16. Для стандартизации раствора HNO3 навеску 1,7594 г Na2B4O7 · 10H2O растворили в мерной колбе вместимостью 100,0 мл. На титрование аликвотной части (V = 15,0 мл) этого раствора затрачено 12,7 мл раствора HNO3. Вычислить молярную концентрацию, молярную концентрацию эквивалента и титр раствора кислоты.
|
|
|
Решение. При титровании протекает следующая реакция:
2HNO3 + Na2B4O7 +5H2O → 2NaNO3 + 4H3BO3
Значит, фактор эквивалентности Na2B4O7 · 10H2O равен 1/2. Рассчитаем концентрацию приготовленного раствора тетрабората натрия по формуле
С = m/(M · V),
где С – молярная концентрация эквивалента, моль/л; m – масса, г; М – молярная масса эквивалента, г/моль; V – объем раствора, л.
М(1/2 Na2B4O7 · 10H2O) = 190,69 г/моль,
С(1/2 Na2B4O7 · 10H2O) =1,7594/(190,69 · 0,1) = 0,09226 моль/л.
По закону эквивалентов рассчитаем молярную концентрацию эквивалента раствора HNO3:
С(1HNO3) = 15,0 ∙ 0,09226/12,7 = 0,1090 моль/л.
Фактор эквивалентности (fэкв.) HNO3 равен единице, поэтому значение молярной концентрации HNO3 совпадает со значением молярной концентрации эквивалента. Титр раствора кислоты рассчитываем по формуле
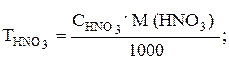
М(HNO3) = 63,013 г/моль [3];
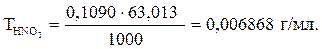
Пример 17 поможет Вам при решении задач №151, 152, 163.
Пример 17. В мерную колбу вместимостью 250 мл поместили 10,0 мл смеси серной и фосфорной кислот, содержимое довели до метки. В две колбы для титрования поместили по 15,0 мл полученного раствора. На титрование первой пробы с метиловым оранжевым израсходовали 27,4 мл раствора NaOH с концентрацией 0,09678 моль/л. На нейтрализацию второй пробы в присутствии фенолфталеина затратили 33,2 мл раствора NaOH той же концентрации. Рассчитать массу серной и фосфорной кислот в исходной смеси.
Решение. Кривые титрования серной и фосфорной кислот показывают, что изменение окраски метилового оранжевого произойдет, когда H2SO4 будет оттитрована по двум ступеням и H3PO4 – по первой ступени. При этом протекают реакции:
| H2SO4 + 2NaOH = Na2SO4 + 2H2O H3PO4 + NaOH = NaH2PO4 + H2O; | } | VT = 27,4 мл. |
Окрашивание фенолфталеина произойдет, когда полностью оттитруется H2SO4, а H3PO4 будет оттитрована по двум ступеням:
|
|
|
| H2SO4 + 2NaOH = Na2SO4 + 2H2O H3PO4 + 2NaOH = Na2HPO4 + 2H2O | } | VT = 33,2 мл. |
Следовательно, разность объемов соответствует количеству титранта, пошедшему на титрование H3PO4 по одной ступени.
Рассчитаем объем раствора NaOH, пошедшего на титрование фосфорной кислоты по одной ступени:
DV = 33,2–27,4 = 5,8 мл.
По закону эквивалентов определим концентрацию фосфорной кислоты в растворе:
С = 0,09678 ∙ 5,8/15,0 = 0,03742 моль/л; М(H3PO4) = 97,9952.
Расчет проведен на основании результатов титрования по одной ступени, следовательно, фактор эквивалентности H3PO4 равен 1. В 250,0 мл раствора и в 10,0 мл анализируемой смеси содержится одинаковое количество H3PO4:
m(H3PO4) =0,03742 ∙ 250,0 ∙ 10–3 ∙ 97,9952 = 0,9168 г.
Объем, пошедший на титрование H2SO4 можно рассчитать, отняв от объема, пошедшего на титрование смеси в присутствии метилового оранжевого, объем, затраченный на титрование H3PO4 по одной ступени. Так, Vр–ра (NaOH), пошедший на титрование серной кислоты,
Vр–ра (NaOH) = 27,4 – 5,8 = 21,6 мл.
Фактор эквивалентности H2SO4 равен ½, так как титрование проходило по двум ступеням. Вычислим концентрацию и массу H2SO4:
С(1/2 H2SO4) = 0,09678 ∙ 21,6/15,0 = 0,1394 моль/л;
m(H2SO4) = 0,1394 ∙ 250,0 ∙ 10–3 ∙ (1/2 98,078) = 1,7086 г.
В задачах 161, 162, 167, 168, 172 используется метод обратного титрования (см. раздел 6.3). При решении этих задач Вам поможет пример 14 на с. 18 [2].
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 4358; Нарушение авторских прав?; Мы поможем в написании вашей работы!