
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Випадки розчинення осадів
|
|
|
|
Дробне осадження
На практиці в якісному аналізі використовують дробне осадження. За правилом ДР в першу чергу, піде реакція при якій утворюється найменш розчинна сполука. Задачі, в яких розглядається додавання реактиву до суміші йонів, розв’язуються теж за правилом ДР.
Приклад. Яка з солей буде осаджатися першою, якщо до суміші 0,1М розчинів KCl і K2CrO4 додавати по краплям AgNO3.
 C(KCl) = C(K2CrO4) = 0.1 моль/л Беремо з довідника ДР(AgCl) = 1,78 · 10-10
C(KCl) = C(K2CrO4) = 0.1 моль/л Беремо з довідника ДР(AgCl) = 1,78 · 10-10
AgNO3 ДР (Ag2CrO4) = 1,1 · 10-12
1) Розраховуємо за якої молярної концентрації Ag+ буде утворюватися осад (AgCl)
AgCl ↔ Ag+ + Cl-
1моль 1моль
х моль 0,1моль
ДР(AgCl) = [Ag+]·[Cl-]
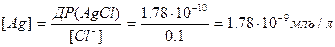
2) Ag2CrO4 ↔ 2Ag++CrO42-
2 моль 1моль
2х моль 0,1моль
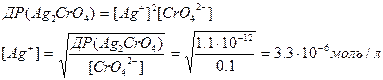
Отже, першим буде осаджуватися AgCl, оскільки для його осадження необхідно значно меншу молярну концентрацію речовини Ag+.
При проведенні хімічного аналізу часто необхідно розчинити осади.
1) Розчинення основ.
Основи, нерозчинні у воді, розчиняються в розведених кислотах. Це пояснюється тим, що у присутності кислоти порушується динамічна рівновага, яка є в насиченому водному розчині основних гідроксидів.
Щоб розчинити осад-основу, треба підібрати такий розчинник, один з йонів якого утворював би слабодисоційовану сполуку з одним з йонів основи, яку розчиняють.
Mg(OH)2 ↔ Mg2+ + 2OH-
Осад розчин
Додали 2НNO3 → 2H++2NO3-
2OH- + 2H+ = 2H2O або
Mg(ОН)2 + 2H+ = Mg2+ + 2H2O
Деякі основи (Mg(OH)2, Fe(OH)2, Mn(OH)2, Ni(OH)2) розчиняються в міцному розчині NH4Cl
Mn(OH)2 ↔ Mn2+ + 2OH-
Осад розчин
Додали 2NH4Cl ↔ 2NH4+ + 2Cl-
2NH4+ + 2OH - ↔ 2NH4OH або
Mn(OH)2 + 2NH4+ ↔ Mn2+ + 2NH4OH
2) Розчинення кислот (кислотних гідроксидів)
Малорозчинні кислотні гідроксиди (H2SiO3, H2WO4, H2MoO4) легко розчиняються в лугах
2NaOH → 2Na+ + 2OH-
H2SiO3 + 2OH-↔ SiO32- + 2H2O
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1074; Нарушение авторских прав?; Мы поможем в написании вашей работы!