
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімія деяких елементів
Таблиця 1.5– Хімія елементів І та ІІ груп
| Ознаки порівняння | І група головна підгрупа (Li, Na, K, Rb, Cs, Fr) | І група побічна підгрупа (Сu, Ag, Au) | ІІ група головна підгрупа (Be, Mg, Ca, Sr, Ba, Ra) | ІІ група побічна підгрупа (Zn, Cd, Hg) |
| Будова валентного електронного шару | ns1 | (n – 1)d10ns1 | ns2 | (n – 1)d10ns2 |
| Ступінь окиснення | +1 | +1, +2 | +2 | Zn - +2, Hg - +1, +2 |
| Фізичні властивості простих речовин | Лужні метали дуже м’які, білого кольору з сріблястим блиском. | Метали, червоного (мідь), білого (срібло) та жовтого (золото) кольорів з металевим блиском. | Mg і лужноземельні метали (Ca, Ba) – м’які, білого кольору з сріблястим блиском. | Метали білого кольору з сріблястим блиском, ртуть – срібляста рідина. |
| Хімічні властивості простих речовин | Лужні метали дуже активні, сильні відновники. | Малоактивні метали. | Лужноземельні метали – активні, сильні відновники. | Метали середньої активності. |
| Одержання простих речовин | Електроліз розплавів солей. | Добувають з руд (CuFeS2, Ag2S). | Електроліз розплавів солей. | Добувають з руд відновленням та електролізом розчинів |
| Сполуки | Гідриди – MetH. Оксиди – Met2O. Гідроксиди– MetOH – луги: тверді кристалічні речовини, типово йонні сполуки, сильні основи. Солі – типово йонні сполуки, як правило добре розчинні у воді. | Оксиди – MetO, Met2O. Гідроксиди – Cu(OH)2 – основа желеподібна, нестійка на повітрі. Солі – йонні сполуки, розчинність у воді різна. | Оксиди MetO – основного характеру. Гідроксиди– Met(OH)2 – тверді кристалічні речовини, типово йонні сполуки, основи середньої сили. Солі – йонні сполуки, розчинність у воді різна. | Оксид (ZnO) і гідроксид (Zn(OH)2) – амфотерного характеру. Тверді кристалічні речовини, типово йонні сполуки. Солі – йонні сполуки, розчинність у воді різна. |
| Продовження таблиці 1.5 | ||||
| Находження в природі | Найбільш розповсюджені сполуки натрію: NaCl – кухонна сіль; Na2SO4·10H2O – Глауберова сіль; NaNO3 – чілійська селітра. KCl – сильвін; KCl+NaCl – сильвініт. | CuFeS2 – мідний колчедан; Cu2S – мідний блиск. Ag2S – сульфідні руди. Срібло і золото зустрічаються у самородному стані. | Сполуки кальцію найбільш розповсюджені: CaCO3 – крейда, мармур, вапняк; CaCO3·MgCO3 – доломіт; CaSO4·H2O – гіпс. MgCO3 – магнезит. | ZnS – цинкова обманка; ZnCO3 – галлей. HgS – кіновар. |
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів І групи
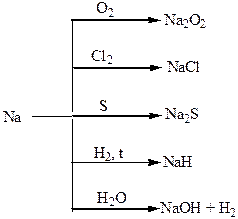
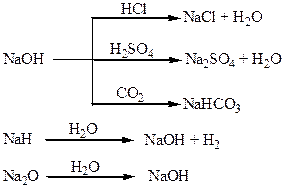

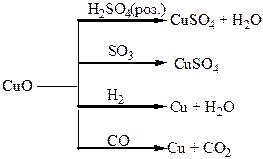
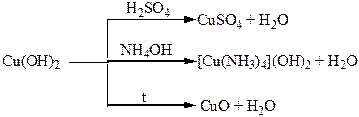
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів ІІ групи


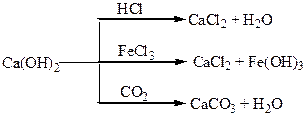
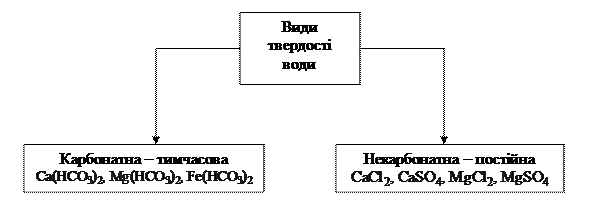
Рис. 1.5. Види твердості води

Рис. 1.6. Методи усунення твердості води
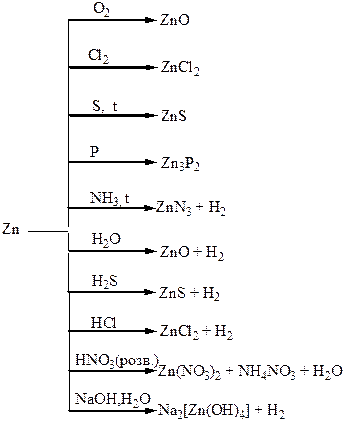
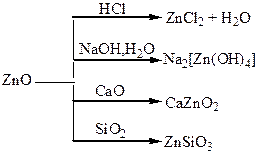
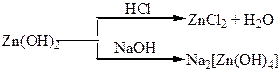
| Таблиця 1.6 – Хімія елементів ІІІ та ІV груп | ||
| Ознаки порівняння | ІІІ група головна підгрупа (B, Al, Ga, In, Tl) | ІV група головна підгрупа (C, Si, Ge, Sn, Pb) |
| Будова валентного електронного шару | ns2np1 | ns2np2 |
| Ступінь окиснення | Al - +3 | +2, +4, (-4) |
| Фізичні властивості простих речовин | Метал алюміній легкий, білого кольору з сріблястим блиском, пластичний. | Карбон – 3 алотропні модифікації (алмаз, графіт, карбін). Аморфний кремній – бурий інертний порошок, алмазоподібна реакційно здатна модифікація – металевий блиск, електропровідність. Олово – сріблясто-білий метал. Свинець – метал голубуватого кольору. |
| Хімічні властивості простих речовин | Метал середньої активності, відновник. | Карбон, силіцій – неметали середньої активності. Свинець досить інертний метал. |
| Одержання простих речовин | Електроліз розплавів солей. | В природі існують поклади графіту. Кремній добувають відновленням оксиду і солей силіцію магнієм чи цинком, олово – відновленням SnO2 коксом, свинець – з сульфідних руд. |
| Сполуки | Оксид (Al2O3) і гідроксид (Al(OH)3) – амфотерного характеру. Тверді кристалічні речовини, типово йонні сполуки. Солі – йонні сполуки, розчинність у воді різна. | Оксиди – неMetO, неMetO2 – кислотного характеру. Гідроксиди – H2SiO3, H2СO3, – слабкі кислоти, нестійкі. MetO, Met(OH)2 – амфотерні: MetO2, Met(OH)4 – основні. |
| Находження в природі | Гірські породи – алюмосилікати. Al2O3·nSiO2 – глини; Al2O3·nH 2O – боксити; Na3AlF6 – кріоліт. | Карбон находіт до складу кам’яного вугілля, нафти. природних газів. CaCO3 – крейда, мармур, вапняк; CaCO3·MgCO3 – доломіт; MgCO3 – магнезит. SiO2 – пісок, кварц; силікати. PbS – свинцевий блиск. |
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів ІІІ групи

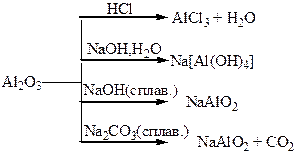

Хімічні властивості простих і складних речовин, утворених атомами деяких елементів ІV групи
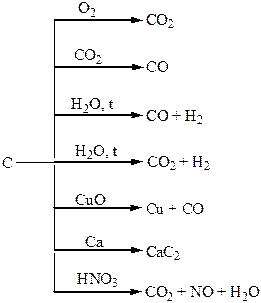
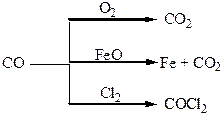
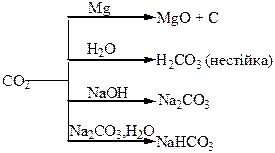
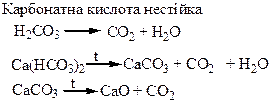
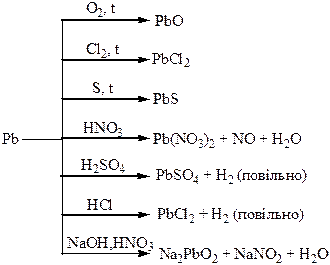


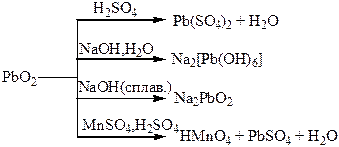
| Таблиця 1.7 – Хімія елементів V та ІV груп | ||
| Ознаки порівняння | V група головна підгрупа (N, P, As, Sb, Bi) | VІ група головна підгрупа (O, S, Se, Te, Po) |
| Будова валентного електронного шару | ns2np3 | ns2np4 |
| Ступінь окиснення | +2, +3, +4, +5. | Оксисен – 2, Сульфур – 2, +4, +6. |
| Фізичні властивості простих речовин | Азот – безбарвний газ без запаху. Алотропні модифікації фосфору – білий, червоний, чорний фосфор. Миш’як – метал. | О2 – безбарвний газ без запаху. Алотропна модифікація оксигену – озон О3 – безбарвний газ з запахом свіжості. Алотропні модифікації сульфуру – сірка ромбічна, пластична, кристалічна. |
| Хімічні властивості простих речовин | Атоми неметалевих елементів можуть віддавати від одного до п’яти електронів в реакціях з простими і складними речовинами. | Кисень і сірка – активні неметали. |
| Одержання простих речовин | Азот одержують ректифікацією повітря. Фосфор одержують електротермічним методом з суміші кальцій фосфату, піску та коксу. | Кисень добувають електролізом води, ректифікацією повітря. Сірку добувають з руд або з самородної сірки. |
| Сполуки | Оксиди Нітрогену і Фосфору – кислотні оксиди. Кислоти: HNO3, HNO2, H3PO4. NH3 – амоніак. Солі: Са3(РО4)2 – “фосфоритна мука”; Са3(РО4)2 + 2Н2SO4 = Са(H2РО4)2 + 2CaSO4 – суперфосфат; Са3(РО4)2 + 4Н3РО4 = 3Са(H2РО4)2 – подвійний суперфосфат; Са(ОН)2 + Н3РО4 = СаНРО4 + 2Н2О – преципітат; 3NH3 + Н3РО4 = NH4H2PO4 + (NH4)2HPO4 – амофос. | H2S – безбарвний газ з неприємним запахом, токсичний, сильний відновник. SO3, SO2 – безбарвні гази з різким запахом, кислотні оксиди, ангідриди відповідних кислот. H2SO4 – сильна кислота, H2SO3 – слабка кислота. |
| Находження в природі | Азот – 78,16% повітря; NаNO3 – чилійська селітра. Са3(РО4)2 – фосфорит; 3Са3(РО4)2·СаF2 – апатит. | Кисень – 23% за масою повітря. Самородна сірка; FeS2 – пірит, залізний колчедан; ZnS – цинкова обманка; Cu2S – мідний блиск. |
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів V групи
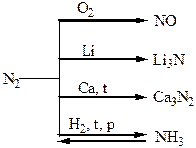
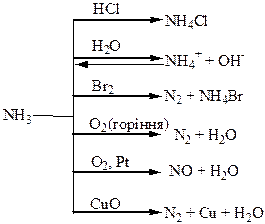

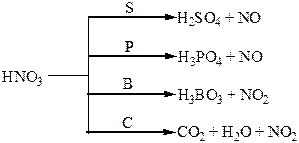



Термічний розклад нітратів металів:
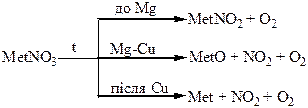



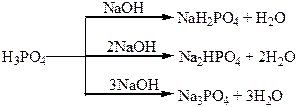
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів VІ групи

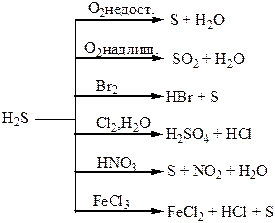
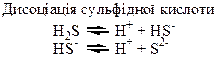
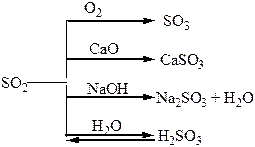







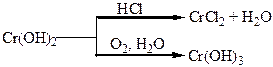
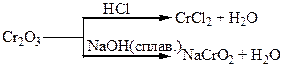



Таблиця 1.8 – Хімія елементів VІІ та VІІІ груп
| Ознаки порівняння | VІІ група головна підгрупа (F, Cl, Br, I, At) | VІІІ група побічна підгрупа (Fe, Ru, Os) |
| Будова валентного електронного шару | ns2np4 | ns2np6(n – 1)d6 |
| Ступінь окиснення | -1, +1, +3, +5,+7. | Fe – +2, +3 |
| Фізичні властивості простих речовин | Сl2 – жовтий токсичний газ, Br2 – коричнева рідина, І2 – чорно-фіолетова кристалічна речовина. Розчинність у воді знижується від хлору до брому. | Залізо – сріблясто білий метал, легко намагнічується, має добру електро- і теплопровідність. |
| Хімічні властивості простих речовин | Найактивніші неметали. | Залізо досить активний метал, тому взаємодіє з більшістю простих і складних речовин. |
| Одержання простих речовин | Хлор одержують електролізом натрій хлориду. Бром і йод одержують з відповідних солей. | Залізо отримують шляхом відновлення воднем його оксидів або хлоридів. |
| Сполуки | Водний розчин НСl – хлоридна кислота, яка має характерні властивості сильних кислот. СаСl(ОСl) – хлорне вапно, дуже сильний окисник. Властивості бромідної кислоти аналогічні властивостям хлоридної, але ця кислота більш сильна (більш сильний відновник). | FeO, Fe2O3 – основні оксиди. Fe(OН)2, Fe(OН)3 – основи. |
| Находження в природі | NaCl – кам’яна сіль; КСl·NaCl – сильвініт. Бром входить до складу цих руд, як домішки. | FeS2 – пірит, залізний колчедан; Fe3O4 – магнітний залізняк; Fe2O3 – червоний залізняк; Fe2O3·3Н2О – бурий залізняк |
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів VІІ групи
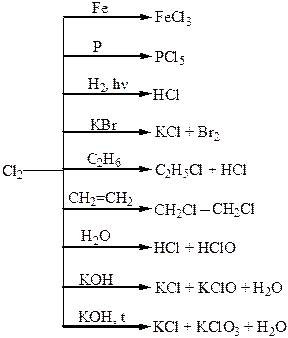

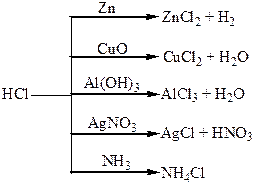
Хімічні властивості простих і складних речовин, утворених атомами деяких елементів VІІІ групи
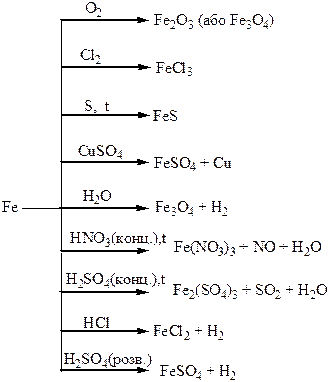

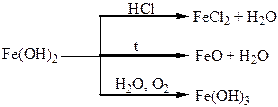
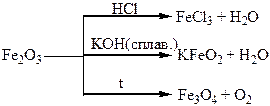
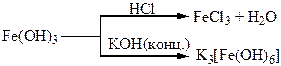
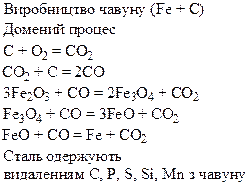
1.11. Література
1. Бабич Л.В., Балезин С.А., Глинка Ф.Б. Практикум по неорганической химии: Учебное пособие для студентов педагогических институтов. – М.: Просвещение. – 1991. – 320 с.
2. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов. – Л.: Химия. – 1986. – 272 с.
3. Глинка Н.Л. Общая химия. – Л.: Химия. – 1980. – 720 с.
4. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа – 2001. – 744 с.
5. Неділько С.А., Попель П.П. Загальна та неорганічна хімія. Задачі і вправи. – К.: Либідь. – 2001. – 398 с.
6. Попель П.П. Складання рівнянь хімічних реакцій. – К.: Рута. – 2000. – 165 с.
7. Волкова С., Бабійчук А., Волкова Л. Індивідуальні завдання з неорганічної хімії (для самостійної роботи студентів психолого-природничого факультету). – Херсон. – 2000. – 69 с.
|
|
Дата добавления: 2014-12-07; Просмотров: 540; Нарушение авторских прав?; Мы поможем в написании вашей работы!