
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения Mn(II)
|
|
|
|
Химические свойства
Получение
Марганец
Марганец и его соединения
Химические свойства
Физические свойства
Свойства элементов подгруппы марганца
Побочная подгруппа VII группы
Подгруппа марганца
ПОДГРУППА МАРГАНЦА
| Атомный номер | Название | Электронная конфигурация | r г/см3 | t°пл. °C | t°кип. °C | ЭО | Атомный радиус, нм | Степень окисления |
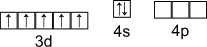
| Марганец Mn | [Ar] 3d54s2 | 7,45 | 1,6 | 0,131 | +2,+3,+4, +5,+6,+7 | |||
| Технеций Tc | [Kr] 4d55s2 | 11,5 | 1,36 | 0,136 | +2,+3,+4, +5,+6,+7 | |||
| Рений Re | [Xe] 4f145d56s2 | 20,53 | 1,46 | 0,137 | +3,+4,+5, +6,+7 |
Серебристо-белые, тугоплавкие металлы.
1. В ряду Mn – Tc – Re химическая активность понижается. Mn – металл средней активности, в ряду напряжений стоит до водорода и растворяется в соляной и серной кислотах:
Mn + 2H+ ® Mn2+ + H2
Re и Tc стоят в ряду напряжений после водорода. Они реагируют только с азотной кислотой:
3Tc + 7HNO3 ® 3HTcO4 + 7NO + 2H2O
2. С увеличением степени окисления усиливается кислотный характер оксидов и гидроксидов. (RO – основные; R2O7 – кислотные, им соответствуют кислоты HRO4).
Электронная конфигурация валентного слоя
Алюмотермия: 3MnO2 + 4Al ® 2Al2O3 + 3Mn
Металл средней активности. На воздухе покрывается тонкой плёнкой оксидов. Реагирует с неметаллами, например, с серой:
Mn + S ® MnS
Растворяется в кислотах:
Mn + 2HCl ® MnCl2 + H2
(При этом образуются соединения двухвалентного марганца).
Оксид марганца (II) MnO получается восстановлением природного пиролюзита MnO2 водородом:
MnO2 + H2 ® MnO + H2O
Гидроксид марганца (II) Mn(OH)2 - светло-розовое нерастворимое в воде основание:
MnSO4 + 2NaOH ® Mn(OH)2¯ + Na2SO4
Mn2+ + 2OH- ® Mn(OH)2
|
|
|
Легко растворимо в кислотах:
Mn(OH)2 + 2HCl ® MnCl2 + 2H2O
Mn(OH)2 + 2H+ ® Mn2+ + 2H2O
На воздухе Mn(OH)2 быстро темнеет в результате окисления:
2Mn(OH)2 + O2 + 2H2O ® 2[MnO2 • 2H2O]
При действии сильных окислителей наблюдается переход Mn2+ в MnO4-:
2Mn(OH)2 + 5Br2 + 12NaOH –кат.CuSO4® 2NaMnO4 + 10NaBr + 8H2O
2Mn(NO3)2 + 5PbO2 + 6HNO3 ® 2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 ® 2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O
(смотри тему "Окислительно - восстановительные реакции", упражнения 3 и 7).
Оксид марганца (IV) MnO2 - тёмно-коричневый порошок, нерастворимый в воде. Образуется при термическом разложении нитрата марганца (II):
Mn(NO3)2 –t°® MnO2 + 2NO2
При сильном нагревании теряет кислород, превращаясь в Mn2O3 (при 600°C) или Mn3O4 (при 1000°C).
Сильный окислитель:
MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
При сплавлении с содой и селитрой образует манганат натрия тёмно - зелёного цвета:
MnO2 + Na2CO3 + NaNO3 –t°® Na2MnO4 + NaNO2 + CO2
Манганаты также могут быть получены при восстановлении перманганатов в щелочной среде:
Na2SO3 + 2KMn+7O4 + 2KOH ® Na2SO4 + 2K2Mn+6O4 + H2O
Гидролиз манганатов протекает по схеме:
3K2MnO4 + 2H2O «2KMnO4 + MnO2 + 4KOH
| MnO2 | MnO42- | MnO4- | ||||
| SO32- –– | 
| Cl2 ––® | 
| ||
| раствор ® | раствор | раствор | ||||
| бурый осадок | H+¯OH- | |||||
| раствор® |  бурый осадок бурый осадок
|
3MnO42- + 2H2O «2MnO4- + MnO2 + 4OH-
За способность обратимо менять окраску манганат калия называют "минеральным хамелеоном".
Оксид марганца (VII) Mn2O7 - тёмно-зелёная жидкость, кислотный оксид. Получают действием концентрированной серной кислоты на кристаллический KMnO4 (марганцевая кислота HMnO4 нестабильна):
2KMnO4 + H2SO4 ® Mn2O7¯ + K2SO4 + H2O
При растворении в щелочах образует перманганаты:
Mn2O7 + 2KOH ® 2KMnO4 + H2O
Перманганат калия KMn+7O4 -тёмно-фиолетовое кристаллическое вещество, растворимое в воде. При нагревании разлагается с выделением кислорода:
2KMnO4 –t°® K2MnO4 + MnO2 + O2
|
|
|
Сильный окислитель, причём восстанавливается в кислой среде до Mn2+, в нейтральной – до Mn+4O2, а в щелочной – до Mn+6O42-.
(смотри тему "Окислительно-восстановительные реакции")
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 878; Нарушение авторских прав?; Мы поможем в написании вашей работы!