
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ситуационные задачи 1 страница
|
|
|
|
ДМПП
Катетеризация сердца проводят взрослым пациентам с высокой лёгочной гипертензией для определения степени гемодинамических нарушений, а также для исключения сопутствующих пороков. Зондирование полостей сердца так же показано при подозрении на лёгочную гипертензию, перед операцией на открытом сердце и при противоречивых клинических данных. Вычисляют отношение лёгочного минутного кровотока к системному (Qp/Qs) — эталонный показатель величины сброса.
Правая атриография, ангиопульмонография: поступление контраста из правого предсердия в левое; выявление сопутствующего аномального дренажа лёгочных вен. При внутривенном контрастировании правых отделов сердца — эффект отрицательного контрастирования (вытеснение контрастного вещества струёй крови из левого предсердия).
Радионуклидная ангиокардиография (по методу первого прохождения или равновесная): регистрация патологического сброса и его количественная оценка, диагностика сопутствующего аномального дренажа лёгочных вен и нарушений функций желудочков.
Показания к оперативному лечению. У взрослых определяющими факторами в решении вопроса о хирургической коррекции порока служит тяжесть его состояния, состояние миокарда и легочных сосудов. Показанием к оперативному лечению при ДМПП является наличие гемодинамически значимого сброса крови слева направо (соотношение лёгочного и системного кровотока составляет 1,5:1 и более), даже в отсутствии симптомов.
Противопоказанием к хирургическому вмешательству может служить высокая лёгочная гипертензия со сбросом крови справа налево, обусловленная склеротическими изменениями лёгочных сосудов, отношение общего лёгочного сосудистого сопротивления к ОПСС 0,9 и более.
|
|
|
Методы оперативного лечения. Эндоваскулярная коррекция пуговичным или двухзаплатным устройством Сидериса либо устройством Амплатц (рис.7) выполнимо при центральных дефектах размером не более 2 см. При отсутствии опыта эндоваскулярного лечения небольшие дефекты ушивают в условиях искусственного кровообращения.
 |
В остальных случаях рекомендуют пластику ДМПП синтетической или аутоперикардиальной заплатой в условиях искусственного кровообращения. При первичном ДМПП или частичной форме открытого АВ-канала пластику дополняют коррекцией недостаточности митрального клапана. В большинстве случаев, коррекцию осуществляют путём ушивания расщеплённой передней створки митрального клапана. Реже прибегают к протезированию клапана. В неосложнённых ситуациях проведение операции позволяет достичь хороших результатов. Послеоперационные осложнения включают: синдром слабости синусового узла (при высоком вторичном ДМПП), полную АВ-блокаду (после коррекции первичного ДМПП). При митральной недостаточности, существовавшей до операции, возможно усугубление симптомов после коррекции ДМПП, так как сброс в ПП блокируется, а митральная неостаточность остается. Фибрилляция предсердий, возникшая до операции, как правило, сохраняется и после неё.
Медикаментозная терапия должна включать быстрое подавление инфекции дыхательных путей, антиритмические препараты при появлении фибрилляции предсердий или суправентрикулярной тахикардии и мероприятия, рекомендуемые при сердечной недостаточност. Несмотря на то, что риск инфекционного эндокардита у этих больных невысок, перед стоматологическими вмешательствами целесообразен профилактический прием антибиотиков. При первичном ДМПП, больших дефектах вторичного ДМПП и сочетании ДМПП с пороками митрального клапана назначают антибиотики до и в течение 6 месяцев после неосложнённой хирургической коррекции.
|
|
|
Прогноз. Изолированный вторичный ДМПП имеет благоприятное течение в первые 2-3 декады жизни. Средняя продолжительность жизни без лечения составляет 36-40 лет, имеются наблюдения забольными, прожившими 70 лет и более, но большинство из них становятся тяжелыми инвалидами в возрасте старше 50 лет, в результате возникшей выраженной ЛГ, правожелудочковой сердечной недостаточности и фибрилляции предсердий. Причиной смерти больных с ДМПП (без операции) является правожелудочковая сердечная недостаточность, реже тромбоз ЛА, эмболии сосудов головного мозга. 5–15% больных умирают до 30 лет. 10-летняя выживаемость — 90%, 20-летняя — 88%, 30-летняя — 67%; 40-летняя — 44%, 50-летняя — 25%, 60-летняя — 13%, 70-летняя — 7%.
Глава 5. Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки (ДМЖП) - ВПС с наличием сообщения между правым и левым желудочками (рис.8). ДМЖП составляет 9–25% всех ВПС, с одинаковой частотой у лиц обоего пола.
|

Почти у 2/3 больных ДМЖП сочетается с другими аномалиями: ДМПП, ОАП, КоА, недостаточностью митрального клапана и др.
Варианты ДМЖП (рис.9):
1. Мембранозные ДМЖП (75%) располагаются в верхней части межжелудочковой перегородки, под клапаном аорты и септальной створкой трёхстворчатого клапана, часто закрываются самопроизвольно
2. Мышечные ДМЖП (10%) располагаются в мышечной части межжелудочковой перегородки, на значительном расстоянии от клапанов и проводящей системы, бывают множественными, фенестрированными и часто закрываются самопроизвольно
3. Надгребневые (ДМЖП выносящего тракта ПЖ, 5%) располагаются выше наджелудочкового гребня, часто сопровождаются аортальной недостаточностью, самопроизвольно не закрываются
4. Открытый АВ-канал (10%) обнаруживают в задней части межжелудочковой перегородки, около места прикрепления колец митрального и трёхстворчатого клапанов, часто встречается при синдроме Дауна, сочетается с первичным ДМПП и пороками развития створок и хорд митрального и трёхстворчатого клапанов, самопроизвольно не закрывается
 |
|
|
|
Рис. 9. Схема расположения ДМЖП
В зависимости от размера ДМЖП выделяют малые (4-5 мм), средние (5-20 мм) и большие (более 20 мм) дефекты.
Нарушения гемодинамики. Сообщение между ЛЖ и ПЖ приводит к сбросу крови слева направо, так как давление в большом круге кровобращения намного превышает давление в малом. Артериальная кровь сбрасывается из ЛЖ в ПЖ и легочную артерию, откуда возвращается в левые отделы сердца. Возникает перегрузка обоих желудочков. Компенсаторно возникающий спазм легочных сосудов препятствует их переполнению кровью и ЛГ в этот период носит «сбросовый» характер. При длительном существовании порока формируется склеротическая фаза ЛГ. Повышение общелегочного сопротивления может быть следствием спазма или склеротически измененных легочных сосудов. Нарастание легочного сосудистого сопротивления в склеротическую фазу ЛГ приводит к тому, что давление в ПЖ и ЛЖ выравниваются. А при увеличении легочного сосудистого сопротивления возможно изменение направления сброса – справа налево. Таким образом, степень функциональных нарушений зависит от величины сброса крови и общего лёгочного сосудистого сопротивления (ОЛСС). При сбросе слева направо и отношении лёгочного минутного объёма кровотока к системному (Qp/Qs) менее 1,5:1 лёгочный кровоток возрастает незначительно, и повышения ОЛСС не происходит. При больших ДМЖП (Qp/Qs более 2:1) значительно увеличиваются лёгочный кровоток и ОЛСС, и давления в правом и левом желудочках выравниваются.
Клиника. Небольшие ДМЖП (до 4-5 мм) часто протекают бессимптомно и могут остаться нераспознанными. Дефекты средних размеров (5-20 мм) дают симптоматику в детстве: отставание в физическом развитии из-за слабости, утомляемости при физической нагрузке, частых инфекций дыхательных путей. При больших дефектах (более 20 мм), как правило, больные редко без операции доживают до зрелого возраста и имеют к этому времени симптомы сердечной недостаточности (одышку, отеки, гепатомегалию, ортопноэ), расширение границ сердца, систолическое дрожание в области левого нижнего края грудины и сердечный горб. В случае развития склеротической стадии ЛГ и нарастании ОЛСС у больных могут появиться головокружения, обмороки, кровохарканье, абсцессы головного мозга, боли в грудной клетке, при смене шунта: диффузный цианоз и «барабанные» палочки.
|
|
|
При аускультации в I-ую гемодинамическую стадию порока (стадия до ЛГ) по левому краю грудины с эпицентром в III-IV м/р слева выслушивается грубый систолический шум, обусловленный сбросом крови из ЛЖ в ПЖ в систолу. В диастолу сброс небольшой, поэтому он не формирует диастолического шума. Причем чем меньше дефект, тем интенсивнее шум («много шума из ничего»). Исчезновение шума – признак неблагоприятный (выравнивание давления в ПЖ и ЛЖ). Над легочной артерией в этой стадии выслушивается расщепление II тона в результате удлинения периода изгнания крови из ПЖ.
Во II стадию порока (стадию ЛГ) систолический шум о левому краю грудины становится коротким, а со временем совсем исчезает, появляется акцент II тона над легочной артерией в сочетании с диастолическим шумом Грехема-Стилла.
Инструментальная диагностика. На ЭКГ при большом сбросе выявляются признаки гипертрофии и перегрузки левых отделов, а при лёгочной гипертензии - и правых.
На рентгенографии органов грудной клетки при большом сбросе выбухание дуги левого желудочка (рис. 10), усиление лёгочного сосудистого рисунка, вследствие увеличения легочного кровотока.
 |  |
|
грудной клетки при ДМЖП
При лёгочной гипертензии — выбухание дуги лёгочной артерии, расширение и неструктурность корней лёгких с резким сужением дистальных ветвей и обеднением лёгочного сосудистого рисунка.
На ДЭХОКГ выявляется гипертрофия и дилатация левых отделов, а при лёгочной гипертензии — и правых, визуализируется ДМЖП в допплеровском и В-режиме (рис. 11), проводится диагностика сопутствующих аномалий (клапанных пороков, коарктация аорты и др.), определяется уровень систолического давления в ПЖ, степень и направление сброса крови.
Катетеризация камер сердца и левая вентрикулография показана при подозрении на лёгочную гипертензию, перед операцией на открытом сердце и при противоречивых клинических данных. Зондирование сердца дает возможность получить полное представление о нарушениях гемодинамики, а вентрикулография позволяет выявить уровень дефекта, исключить возможное наличие множественных дефектов, вычислить отношение лёгочного минутного кровотока к системному (Qp/Qs) — эталонный показатель величины сброса.
Показания к оперативному лечению. У взрослых определяющими факторами в решении вопроса о хирургической коррекции порока служит тяжесть его состояния, состояние миокарда и легочных сосудов. Показанием к оперативному лечению при ДМПП является наличие гемодинамически значимого сброса крови слева направо (соотношение лёгочного и системного кровотока составляет 1,5:1 и более), даже в отсутствии симптомов.
Противопоказанием к хирургическому вмешательству может служить высокая лёгочная гипертензия со сбросом крови справа налево, обусловленная склеротическими изменениями лёгочных сосудов, отношение общего лёгочного сосудистого сопротивления к ОПСС 0,9 и более.
Методы оперативного лечения. Оперативное лечение ДМЖП выполняют в условиях искусственного кровообращения, гипотермии и кардиоплегии. Небольшие дефекты (до 5 мм) ушивают, а более крупные закрывают заплатой. Эндоваскулярное закрытие краёв перимембранозного ДМЖП (при помощи специальных устройств) проводят в случае обнаружения большого расстояния между краями дефекта и полулунными (или атриовентрикулярными) клапанами. Тот же метод используют при хирургическом лечении мышечных ДМЖП.
Послеоперационная летальность не превышает 1%. Пациенты, оперированные по поводу крупных ДМЖП, нуждаются в наблюдении в течение всей жизни (вследствие возможности прогрессирования ЛГ).
Специфические послеоперационные осложнения: инфекционный эндокардит, АВ-блокада, желудочковые аритмии, реканализация ДМЖП, недостаточность трёхстворчатого клапана.
Медикаментозное лечение. При застое в малом круге кровообращения — периферические вазодилататоры (гидралазин или нитропруссид натрия), уменьшающие сброс слева направо. При правожелудочковой недостаточности — диуретики. До и в течение 6 месяцев после неосложнённой хирургической коррекции ДМЖП — профилактика инфекционного эндокардита.
Прогноз. Средняя продолжительность жизни без оперативного лечения около 23-27 лет, при небольших размерах дефекта – около 60 лет. Причины смерти: сердечная недостаточность, ЛГ, инфекционный эндокардит, тромбозы, разрыв аневризмы легочной артерии.
Глава 6. Открытый артериальный проток
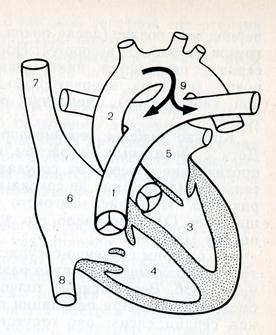
Открытый артериальный порок (dustus arteriosus, боталлов проток) (ОАП) – сосуд, соединяющий аорту и легочную артерию, сохранивший нормальную для плода структуру после истечения срока его закрытия (рис. 12).
ОАП является одним из наиболее распространенных пороков: по клиническим данным частота его составляет 10-18% от всех ВПС, по патологоанатомическим данным – 3% от всех ВПС, среди популяции – 0,3%.
ОАП располагается в верхнем отделе переднего средостения и прикрыт листком париетальной плевры. Проток отходит от аорты на уровне левой подключичной артерии и в большинстве случаев впадает в ствол легочной артерии в месте его деления на две ветви или в начальную часть левой ветви.
 |
Рис. 12. Схема расположения ОАП
Он может быть изолированным или в 5-10% сочетаться с другими ВПС. ОАП имеют в течение нескольких месяцев жизни 50% детей, рожденных с массой менее 1700г; у 20% он остается незакрытым в течение 1-2 лет. Проток может быть длинным, узким и извилистым или коротким и широким, диаметр его составляет от 2-3 до 30 мм, чаще 3-15 мм, длина 3-25 мм. Систолодиастолический шум слышен, если диаметр протока превышает 4 мм. В зависимости от формы протока существуют различные анатомические типы порока: цилиндрический, воронкообразный, окончатый, аневризматический.
Нарушения гемодинамики. При ОАП происходит сброс оксигенированной крови из аорты в легочную артерию, поэтому это порок бледного типа. Сброс из аорты происходит и во время систолы, и в период диастолы, так как в обе эти фазы давление в аорте превышает таковое в легочной артерии (рис.13).
 | |||
| |||
Клинически тяжесть течения порока определяется следующими факторами: 1) размерами протока; 2) углом отхождения его (более благоприятно, если он отходит под острым углом, хуже – если под тупым, поскольку это способствует большему сбросу); 3) величиной общелегочного сопротивления. При большом протоке значительное количество крови поступает в легочную артерию, затем в левые отделы, вызывая их объемную перегрузку. Кроме того, давление в аорте передается непосредственно через проток в легочную артерию, что способствует раннему развитию легочной гипертензии. В таких случаях, если сопротивление в малом круге кровообращения будет превышать таковое в большом, возникает обратный веноартериальный сброс и появляется цианоз. Гемодинамические нарушения при ОАП обуславливают расширение преимущественно левых отделов сердца, но при развитии ЛГ, особенно в ее склеротической стадии, преобладает дилатация и гипертрофия правого желудочка.
Клиника. При небольших и средних размерах протока течение порока длительно может быть бессимптомным. Подростки и взрослые больные с ОАП часто не отстают от сверстников в физическом развитии. Ухудшение возникает в пубертантный период или позже: после родов, значительной физической нагрузки, занятием спортом. Постепенно увеличиваются размеры сердца, появляется цианоз вначале при нагрузке, затем в покое (признак веноартериального сброса и высокой ЛГ), медленно развивается сердечная недостаточность.
При ОАП с кардиомегалией рано развивается парастернальный сердечный горб. Верхушечный толчок приподнимающийся, разлитой, смещен к низу. При пальпации определяется дрожание у основания сердца слева: оно отсутствует или исчезает у больных с небольшим протоком или при развитии высокой ЛГ. При аускультации в I гемодинамическую стадию порока слышен характерный систолодиастолический («машинный») шум с максимальным звучанием во втором межреберье слева от грудины. Шум нарастает ко второму тону и убывает в диастолу. Механизм шума обусловлен сбросом крови из аорты в легочную артерию и в систолу и в диастолу из-за разницы давлений в обе эти фазы в аорте и легочной артерии. Отмечается акцент II тона над легочной артерией. Во II стадию порока при развитии склеротической стадии ЛГ, увеличении легочного сосудистого сопротивления происходит выравнивание давления в легочной артерии и аорте сначала в диастолу и диастолический компонент шума уменьшается, а затем и вовсе исчезает. В III гемодинамическую стадию порока происходит выравнивание давления в легочной артерии и аорте и в систолу и систолический шум становится мягче, короче и исчезает, так как общее легочное сосудистое сопротивление достигает величины системного и сброс крови из аорты в легочную артерию прекращается. В это время появляется цианоз, вначале только при физической нагрузке, а затем постоянный. Цианоз в большей мере выражен на нижних конечностях, чем на лице и верхних конечностях и свидетельствует о смене направления шунта. Над верхушкой сердца может выслушиваться шум недостаточности митрального клапана (митрализация порока, свидетельствующая о дилатации левого желудочка).
Для ОАП характерен высокий, быстрый пульс. При этом определяется нормальное или несколько повышенное систолическое и низкое диастолическое (до 30-40 мм рт.ст.) АД вплоть до появления феномена нулевого диастолического давления, что объясняется диастолическим оттоком крови из аорты через ОАП в легочную артерию. Определение пульса на бедренных артериях, измерение АД на ногах является обязательным из-за частого сочетания ОАП с коарктацией аорты.
Признаком большого левоправого сброса через проток является сердечная недостаточность, как правило, смешанного характера: стойкая тахикардия, тахипноэ, увеличение печени. Появление сердечной недостаточности у взрослых больных с ОАП – прогностически неблагоприятный признак.
Осмотр и аускультация больных с ОАП требуют внимания также и потому, что он нередко сочетается с другими ВПС бледного типа или маскируют пороки с цианозом. При сочетании ОАП с ДМЖП дополнительно прослушивается грубый систолический шум в третьем – четвертом межреберье слева у грудины. Заподозрить наличие коарктации аорты помогает снижение или отсутствие пульсации и АД на бедренных артериях, высокое АД на руках, грубый систолический шум на основании сердца и спине.
Одним из возможных осложнений при ОАП является бактериальный эндокардит. Вегетации находят в просвете протока со стороны легочной артерии, поэтому возможна эмболия в нее. Другим осложнением могут быть развитие аневризмы протока и ее разрыв. В одних ситуациях это связано с особенностями анатомического строения, в других – с легочной гипертензией или бактериальным эндокардитом.
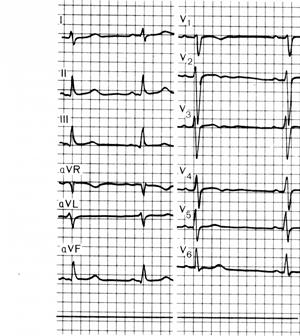
Инструментальная диагностика. На ЭКГ ведущими являются признаки гипертрофии миокардаЛЖ (рис. 14). По мере увеличения сброса и повышения давления в легочной артерии появляются, а затем могут стать ведущими признаки гипертрофии миокарда ПЖ. У больных может появиться фибрилляция предсердий (при дилатации полости левого предсердия).
 |  |
|
На рентгенограмме грудной клетки при ОАП отмечается усиление легочного рисунка, соответствующее величине артериовенозного сброса, расширение или выбухание ствола легочной артерии, увеличение тени сердца за счет сначала левого, а затем обоих желудочков и ЛП. Признаками ЛГ является так называемый «обрубленный» (ослабление его на периферии) или асимметричный легочный рисунок в сочетании с выбуханием дуги легочной артерии. Если ЛГ при этом носит «сбросовый» характер, объем сердца увеличен значительно; при высоком общелегочном сопротивлении из-за развития склеротических изменений в легочных сосудах и снижения сброса объем сердца уменьшается. У взрослых больных бывает видна кальцификация протока.
На ДЭХОКГ характерно увеличение полости ЛЖ и изменение отношения размера ЛП к диаметру аорты. В норме размер ЛП равен диаметру аорты или несколько меньше его. При 2-хмерной ЭХОКГ иногда удается визуализировать расширенный артериальный проток. Допплеровское исследование выявляет постоянный, занимающий всю систолу и диастолу поток в стволе легочной артерии.
При катетеризации правых отделов сердца косвенным признаком порока может быть повышение насыщения крови кислородом на уровне легочной артерии, увеличение давления в ней. Наиболее достоверным является проведение катетера из легочной артерии в аорту, когда он описывает своеобразную кривую в виде греческой буквы «j» (рис. 15). Во время удаления катетера регистрируется кривая аортального, затем легочного давления. В случаях ЛГ при катетеризации сердца выявляют систолическое давление в легочной артерии, равное или превышающее давление в аорте, констатируют перекрестный сброс крови или сброс крови справа налево.
При аортографии виден сброс контрастированной крови из аорты в легочную артерию и можно оценить размеры протока.
Показаниями к хирургическому лечению порока у взрослых - установление диагноза ОАП. При этом, возраст не должен служить противопоказанием к хирургическому лечению, хотя у взрослых оно сопряжено с большим риском и технически сложнее (проток часто истончен, инфицирован, склерозирован).
Противопоказанием к оперативному лечению ОАП является: право левый сброс, так как проток в этих условиях выполняет роль разгрузочного клапана для правого сердца.
Медикаментозное лечение включает профилактику инфекционного эндокардита до и в течение 6 месяцев после хирургической коррекции, лечение сердечной недостаточности общепринятыми методами.
Прогноз. Средняя продолжительность жизни у неоперированных больных с ОАП составляет 39 лет, к 30 годам умирает 20% больных, к 45 годам – 42%, к 60 – 60%. Причинами смерти больных ОАП чаще являются: инфекционный эндокардит (30%), ТЭЛА, аневризма протока и ее разрыв, аневризма легочной артерии, сердечная недостаточность.
Глава 7. Коарктация аорты
Коарктация аорты (КоА) представляет собой врожденное сужение или полный перерыв аорты в области перешейка ее дуги, иногда в грудной или брюшной части. Частота порока составляет от 6,3 до 15% всех ВПС. КоА встречается в 2 раза чаще у мужчин, чем у женщин. Обычно КоА обнаруживают в «типичном» месте при переходе дуги в нисходящую часть аорты, так как здесь и в норме имеется сужение.
По анатомическим особенностям можно выделить три варианта КоА (рис.16):
1) изолированная коарктация («взрослый» тип);
2) коарктация в сочетании с открытым артериальным пороком (ОАП): постдуктальная (расположена ниже отхождения ОАП), юкстадуктальная (проток открывается на уровне сужения), предуктальная (артериальный проток отходит ниже коарктации). При постдуктальной коарктации кровь из аорты под высоким давлением сбрасывается через ОАП в легочную артерию, при этом может рано развиваться ЛГ. При предуктальном варианте направление сброса через артериальный проток будет определяться разницей давлений между легочной артерией и нисходящей аортой ниже места коарктации; сброс может быть артериовенозным и веноартериальным. Последний объясняет дифференцированный цианоз (он есть на ногах и нет на руках) как клинический признак предуктальной коарктации. При сочетании КоА с ОАП рано развивается тотальная сердечная недостаточность и такой порок диагностируется в детстве.
3) коарктация в сочетании с другими ВПС (ДМЖП, ДМПП и др.).

Рис. 16. Варианты коарктации аорты: а) постдуктальная; б) предуктальная с локальным сужением; в) предуктальная с сужением на протяжении. 1- коартктация аорты; 2- ОАП
У взрослых чаще встречается изолированная коарктация аорты («взрослый» тип).
Нарушения гемодинамики при изолированной КоА. При изолированной КоА механическое препятствие на пути кровотока в аорте ведет к развитию двух гемодинамических режимов кровообращения: проксимальнее сужения АД повышено, что сопровождается увеличением минутного объема и работы ЛЖ, дистальнее препятствия АД снижено, кровообращение осуществляется за счет коллатералей. Они выглядят дилатированными, извитыми, увеличивают приток крови от восходящей к нисходящей аорте, минуя коарктацию. Патогенез артериальной гипертензии при КоА сложен и до конца не ясен. Механическая обструкция, активация системы ренин-ангиотензин-альдостерон (на фоне недостаточной перфузии почек) и органические изменения в сосудистой стенке приводят к увеличению общепериферического сопротивления.
Клиника. Больные жалуются на головокружения, тяжесть и боли в голове, повышенную утомляемость, носовые кровотечения, возможны боли в сердце. Одновременно отмечаются жалобы на слабость и боли в ногах, судороги в мышцах ног, зябкость ног, иногда эти проявления напоминают синдром перемежающейся хромоты. Сердечная недостаточность возникает обычно после 20-30 лет и является прогностически неблагоприятным признаком. При отсутствии жалоб повышенное АД обнаруживают случайно, иногда больные наблюдаются с диагнозом «артериальная гипертензия неясного генеза» (эссенциальная). При осмотре отмечается хорошее физическое развитие с диспропорцией мышечной системы: мышцы верхней половины гипертрофированы при относительной гипотрофии мышц таза и нижних конечностей, ноги на ощупь холодные. При пальпации межреберных артерий (больного наклоняют вперед с опущенными руками) отмечается их повышенная пульсация. Систолическое АД на ногах на 50-60 мм рт. ст. ниже, чем на руках (в норме наблюдается обратное соотношение), при нормальном диастолическом АД, т.е. имеется небольшое пульсовое давление на ногах – признак КоА. Нередко АД на ногах вообще не определяется, а на руках обнаруживается высокая гипертензия систолодиастолического характера, которая может стать причиной внезапного кровоизлияния в мозг. Границы сердца умеренно и резко расширены, верхушечный толчок усилен, приподнимающийся.
Систолический шум грубого тембра шума изгнания различной продолжительности лучше выслушивается на основании сердца или сзади в межлопаточной области слева (место проекции перешейка аорты). II тон над аортой акцентирован.
Инструментальная диагностика. При изолированной КоА на ЭКГ имеются признаки гипертрофии ЛЖ.
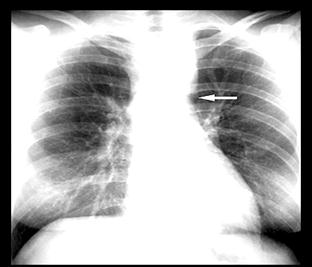
На рентгенограмме грудной клетки определяется узурация нижних краев ребер из-за давления резко расширенных и извитых межреберных артерий, наблюдается расширение тени восходящей аорты (рис. 17). При контрастировании пищевода отмечается расширение аорты выше и ниже места сужения.
 | |||
 | |||
Рис. 17. Рентгенограмма при коарктации аорты
ДЭХОКГ позволяет выявить у больных с КоА место сужения, турбулентный ускоренный поток крови за местом стеноза (рис.18), косвенно определить градиент давления.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1567; Нарушение авторских прав?; Мы поможем в написании вашей работы!