
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Температура горения
|
|
|
|
Расход воздуха при полном сгорании 1 кг горючего вещества при нормальных условиях
| Горючее вещество | 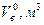
| Горючее вещество | 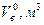
|
| Ацетон Ацетилен Бутан Бензин Водород Древесина (W=7%) | 7,35 11,93 30,94 11,1 2,38 4,18 | Керосин Метан Нефть Оксид углерода Пропан Природный газ | 10,8 9,52 10,8 2,38 23,8 5,0 |
Выделяющееся в зоне горения тепло передается продуктам сгорания, которые нагреваются до высокой температуры.
Продуктами сгорания называют газообразные, жидкие и твердые вещества, образующиеся в результате соединения горючего вещества с кислородом воздуха в процессе горения. При пожарах чаще всего горят органические вещества (древесина, ткани, бензин, нефть, резина и др.), в состав которых входят главным образом углерод, водород, азот, кислород, сера. При их полном сгорании образуются СО2, Н2О, N2, SO2, при неполном (при недостатке кислорода воздуха), - кроме продуктов полного сгорания, образуются СО и С.
Реже при пожарах горят неорганические вещества, такие как фосфор, натрий, калий, кальций и др. Продуктами их сгорания, как правило, являются твердые вещества, например, Р2О5, СаО, Na2O2. Образуются они в дисперсном состоянии, поэтому поднимаются в воздух в виде плотного дыма. Дым – дисперсная система, состоящая из мельчайших твердых частиц, взвешенных в смеси продуктов сгорания с воздухом. Диаметр частиц дыма колеблется от 1 до 0,01 мкм.
Продукты сгорания называют влажными, если при расчёте их состава учитывают пары воды, и сухими, если содержание паров воды не учитывается.
Различают калориметрическую, теоретическую и действительную температуры горения.
Под калориметрической температурой горения понимают ту температуру, до которой нагреваются продукты сгорания при следующих условиях: происходит полное сгорание; всё выделяющееся при горении тепло расходуется на нагревание продуктов сгорания (потери тепла равны нулю); начальные температуры горючего вещества и воздуха равны 0оС.
|
|
|
Теоретическая температура в отличие от калориметрической характеризует горение с учётом эндотермического процесса диссоциации продуктов сгорания при высокой температуре. Диссоциацию продуктов сгорания учитывают при t >17000.
Действительная температура горения характеризует условия реальных пожаров. При пожарах не вся теплота, выделяющаяся при горении, расходуется на нагревание продуктов сгорания. Значительная её часть затрачивается на подготовку горючих веществ к горению, нагрев окружающего воздуха и ограждающих конструкций. Действительная температура горения ниже калориметрической.
При определении калориметрической температуры горения можно воспользоваться рекомендациями [6]. Принимается, что энергия Q т, необходимая для нагревания продуктов сгорания от 0 оС до калориметрической температуры, равна низшей температуре сгорания Qн
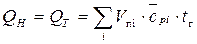 , (2.19)
, (2.19)
где Vпi - объём i-го продукта сгорания, 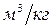 ;
; 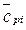 -средняя объёмная теплоёмкость i-го продукта сгорания при постоянном давлении и изменении температуры от 0 оС до t г,
-средняя объёмная теплоёмкость i-го продукта сгорания при постоянном давлении и изменении температуры от 0 оС до t г, 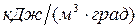 ; t г-температура горения, оС. Величину Q т называют теплосодержанием продуктов сгорания.
; t г-температура горения, оС. Величину Q т называют теплосодержанием продуктов сгорания.
Если горючее вещество задано формулой 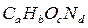 , объём продуктов сгорания, определяемых по уравнению (1.34), можно найти по соотношениям:
, объём продуктов сгорания, определяемых по уравнению (1.34), можно найти по соотношениям:
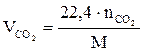 ;
; 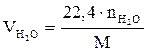 ;
; 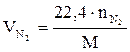 , (2.20)
, (2.20)
где 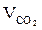 ,
, 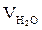 ,
,  - объём углекислого газа, паров воды, азота,
- объём углекислого газа, паров воды, азота, 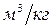 ;
;
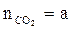 ,
, 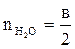 ,
, 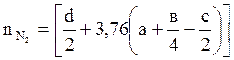 - число киломолей углекислого газа, паров воды, азота в уравнении реакции горения;
- число киломолей углекислого газа, паров воды, азота в уравнении реакции горения;
М - масса горючего вещества, численно равная молекулярной массе, кг.
Пусть горючее вещество – сложное химическое соединение. Если известен его элементный состав, то состав и количество продуктов сгорания 1 кг данного вещества можно определить по уравнениям реакции горения определенных элементов.
|
|
|
Реакции горения углерода, водорода, серы имеют вид:
С+О2+ 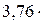 N2=CО2+
N2=CО2+ 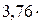 N2+ Q сг
N2+ Q сг
Н2+ 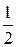 О2+
О2+ 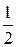 ·3,76N2=Н2О + 1,88 N2+ Q сг (2.21) S+О2+
·3,76N2=Н2О + 1,88 N2+ Q сг (2.21) S+О2+ 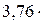 N2=SO2+
N2=SO2+ 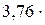 N+ Q сг
N+ Q сг
При сгорании 1 кг углерода получается 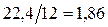 м3 СО2 и 22,4·3,76/12=7,0 м3 N2; при сгорании 1кг серы образуется 0,7 м3 SO2 и 2,63м3 N2; при сгорании 1 кг водорода образуется 11,2 м3 H2O (паров воды) и 21 м3 N2.
м3 СО2 и 22,4·3,76/12=7,0 м3 N2; при сгорании 1кг серы образуется 0,7 м3 SO2 и 2,63м3 N2; при сгорании 1 кг водорода образуется 11,2 м3 H2O (паров воды) и 21 м3 N2.
В состав горючего вещества могут входить азот и влага, которые в процессе горения переходят в продукты сгорания. Для их учёта необходимо знать объём 1 кг азота и 1 кг паров воды при нормальных условиях, а именно 0,8 м3 N2 и 1,24 м3 Н2О.
Если в состав горючего вещества входит кислород, который также участвует в горении, то воздуха на горение расходуется соответственно меньше. Следует отметить, что в воздухе при 0оС и давлении 101,3 кПа на 1кг кислорода приходится  м3 азота.
м3 азота.
С учётом приведенных данных определяют состав и объём продуктов сгорания 1кг горючего вещества. В качестве примера в табл.10 приведены результаты расчёта состава и объёма продуктов сгорания при сгорании 1кг каменного угля, в состав которого входят: углерод - 75,8%, водород - 3,8%, кислород - 2,8%, азот - 1,1%, сера - 2,5%, влага - 3%, зола - 11% [6].
Таблица 10
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 869; Нарушение авторских прав?; Мы поможем в написании вашей работы!