
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные системы
|
|
|
|
Одним из характерных свойств внутренней системы организмов является постоянство концентрации водородных ионов (изогидрия). Так, например, рН крови человека – 7,36. Сохранение этого показателя обеспечивается совместным действием ряда физико-химических и физиологических механизмов, из которых очень важная роль принадлежит буферным системам.
Буферными системами называются растворы, обладающие свойством достаточно стойко сохранять постоянство концентрации водородных ионов как при добавлении к ним небольшого количества сильных кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) кислотные - слабая кислота и ее соль, образованная этой кислотой с сильным основанием;
б) основные - слабое основание и его соль, образованная этим основанием и сильной кислотой.
На практике часто применяются следующие буферные смеси:
СН3 СООН
СН3СООNa - ацетатный буфер;
Н2СО3
NaHCO3 - бикарбонатный буфер;
NH4OH
NH4Cl - аммиачный буфер
КН2PO4
Na2HPO4 - фосфатный буфер
Pt – COOH – белок-кислота
Pt – COONa – белок-соль - белковый буфер (Pt – протеин-белок).
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система и стремится сохранить при добавлении кислот или щелочей. Рассмотрим, что определяет постоянство рН, например, ацетатной буферной смеси
СН3СООН Û Н+ + СН3СОО -
СН3СООNa ÞСН3СОО- + Na+
В ацетатном буферном растворе концентрация водородных ионов будет зависеть от степени диссоциации молекул кислоты. Согласно закону действия масс, константа диссоциации уксусной кислоты будет:
К = 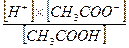 , откуда
, откуда
[H+ ] = К× 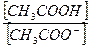
При добавлении к слабодиссоциированной уксусной кислоте (К = 1,86× 10-5) ее сильнодиссоциированной соли происходит резкое увеличение концентрации общего аниона (СН3СОО -). В соответствие с законом действия масс это вызывает смещение равновесия влево, т.е. приводит к увеличению недиссоциированных молекул кислоты:
|
|
|
СН3СООН Ü СН3СОО - + Н+
Слабая диссоциация уксусной кислоты еще в большей степени будет подавлена и концентрация недиссоциированных молекул кислоты может быть принята равной общей концентрации кислоты. Так как соль полностью диссоциированна на ионы, то общая концентрация анионов может быть принята за общую концентрацию соли в буферном растворе. Исходя из этого, концентрацию ионов водорода в буферной смеси можно представить в следующем виде:
[H+ ] = Кк× 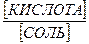
Для основного буфера, каким является, например аммиачный, соответственно будет
[OH -] = Ко× 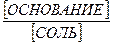
Данные выражения являются основным уравнением буферных растворов. В логарифмической форме эти уравнения принимают вид:
pH = pKк + lg[соль] – lg[кислота].
рH = pKо + lg[основание] - lg[соль].
Таким образом, рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентрации компонентов буферных смесей. Используя основное уравнение буферного раствора, можно вычислить рН любого буферного раствора, зная константу электролитической диссоциации кислоты или основания и концентрации кислоты и соли, а при одинаковых концентрациях их объемные отношения.
Предел, в котором проявляется буферное действие буферной системы характеризуется буферной емкостью. Численное значение буферной емкости (Б) определяется числом моль сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферной смеси, чтобы изменить значение рН на 1:
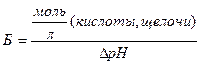 ,
,
где: DрН – изменение рН при титровании буфера кислотой или щелочью, наиболее близкое к 1 (DрН = рН1 – рН0).
|
|
|
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 400; Нарушение авторских прав?; Мы поможем в написании вашей работы!