
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пептизация коллоидов.
|
|
|
|
Процесс пептизации является процессом, обратным коагуляции - это процесс растворения коллоидного осадка (геля) и образование вновь коллоидного раствора (золя).
Процессу пептизации подвергаются не все коллоидные осадки, а только те, которые содержат в себе большое количество растворителя и коллоидные частицы которых еще сохраняют некоторые индивидуальные свойства. У лиофильных коллоидов устранение фактора, вызвавшего коагуляцию, вызывает переход образовавшегося геля вновь в состояние золя. Так, добавление воды в коагель, который был образован от добавления этилового спирта в гидрозоль желатина, вновь переводит этот гель в состояние золя. Такие коллоиды называются обратимыми.
Коагель, образованный в результате коагуляции лиофобного золя, разбавлением раствора, вызвавшего коагуляцию, перевести в состояние золя невозможно. Такие коллоиды называются необратимыми.
И все-таки гидрофобные коллоиды способны к пептизации. При пептизации лиофобных коллоидов основным процессом является восстановление зарядов на коллоидной частицах, утраченных в процессе коагуляции. Осуществить процесс пептизации может тот ион, который способен адсорбироваться на поверхности частицы и сообщить ей заряд. При пептизации происходит химическое взаимодействие между прибавляемым пептизатором (электролитом) и пептизируемым коллоидом. В качестве примера пептизации гидрофобного золя можно привести пептизацию коагулята гидроокиси железа добавлением очень малых количеств хлорного железа. При этом происходит адсорбция ионов железа поверхностью частиц геля. Другим примером пептизации является очищающее действие мыльных растворов.
|
|
|
Коагуляция лиофильных (гидрофильных) коллоидов.
К классу лиофильных коллоидов относятся растворы высокомолекулярных соединений. Растворы ВМС аналогично истинным растворам обладают абсолютной агрегативной устойчивостью. Высокая устойчивость растворов ВМС определяется наличием на поверхности частиц двух оболочек - электрической и сольватной (гидратной). Поэтому для коагуляции растворов ВМС необходимо не только нейтрализовать заряд коллоидной частицы, но и разрушить жидкостную оболочку. Выделение ВМС из растворов по своей природе отличается от коагуляции типичных гидрофобных золей. Так, если для гидрофобных золей достаточно незначительных добавок электролитов, чтобы вызвать их коагуляцию, то для ВМС этого недостаточно. Для выделения дисперсной фазы полимеров необходимы высокие, вплотьдо насыщенных, концентрации электролитов. Явление выделения в осадок растворенного ВМС под действием большой концентрации электролита получило название высаливание.
Всякое вещество, способное сольватироваться растворителем ВМС и понижать его растворимость, пригодно для высаливания. Так, например, спирт и ацетон способны отлично высаливать желатину из ее водных растворов. Аналогично происходит осаждение спиртом белка из водного раствора или осаждение ацетоном каучука из раствора бензола.
Коагуляция лиофильных коллоидов достигается прибавлением к золю десольватирующих веществ. Такими десольватирующими веществами являются спирт, ацетон, пересыщенные растворы электролитов, т.е. такие вещества, которые, не изменяя самих частиц, отнимают воду у этих частиц. При коагуляции гидрофильных коллоидов под действием пересыщенных растворов электролитов имеет важнейшее значение гидратация самих ионов: чем менее гидратирован сам ион, тем выше его коагулирующая сила. При высаливании (коагуляции ВМС) решающую роль играет не валентность иона, а его способность к гидратации и к адсорбции на коллоидно-дисперсных частицах.
|
|
|
Как отмечалось выше, коагуляция лиофильных коллоидов носит обратимый характер.
Вопросы для самоконтроля:
1. В каком месте коллоидной мицеллы возникают полный и электрокинетический потенциалы?
2. Явление электрофореза и электроосмоса.
3. Что такое коагуляция коллоидных систем?
4. Правило Шульце-Гарди.
5. Чем можно вызвать коагуляцию гидрофобных коллоидов?
6. Как по коагуляции можно отличить гидрофобный коллоид от растворов ВМС?
7. Механизм коагуляции гидрофобных коллоидов.
8. Механизм высаливания растворов ВМС.
Экспериментальная часть:
Задание 1. Коагуляция гидрофобных коллоидов. Определение порога коагуляции и вычисление коагулирующей силы.
Коагуляцию гидрофобных золей осуществляют действием следующих растворов: КС1, K2SO4, СаС12 (все растворы 1 М).
Изучая коагулирующее действие указанных растворов, необходимо определить пороги коагуляции коллоидов этими электролитами. Чем меньше порог коагуляции, тем больше коагулирующая сила иона, вызвавшего коагуляцию данного коллоида (по правилу значности и валентности).
В пробирки, установленные в штативе (кроме двух), наливают по 1 мл испытуемого золя (по заданию преподавателя). Готовят контрольный раствор: в первую пробирку с 1 мл испытуемого золя добавляют 1мл дистиллированной воды. Пипеткой берут из колбы с 1 М раствором КС1 1 мл и добавляют в следую пробирку с гидрозолем. Сравнивая содержимое этой пробирки с контрольным раствором, убеждаются в том, что хлористый калий такой концентрации вызывает коагуляцию коллоида. Отмечают в таблице 23 наличие коагуляции знаком «+» и приступают к разбавлению раствора КС1.
Таблица 23
Результаты определения порога коагуляции гидрофобных золй.
| № п/п | концентрация электролита С, ммоль/л | номер испытуемого золя | ||
| КС1 | K2SO4 | СаС12 | ||
| и т.д. |
Возьмите две оставшиеся чистыми пробирки и опустите каждую из них по пипетке на 1 мл, предварительно помыв. В одну из этих пробирок налейте произвольное количество дистиллированной воды (она потребуется для разбавления электролита), во вторую - 1 мл 1 М КС1 и добавьте из пробирки с дистиллированной водой 1 мл. Размешайте содержимое пробирки 2 продуванием воздуха через пипетку и из образовавшихся 2 мл раствора КС1 отберите этой же пипеткой 1 мл раствора и перенесите его в пробирку с золем. Пипетку в золь не опускать, а сливать электролит по стенке пробирки! Осторожно размешайте содержимое пробирки и, если раствор помутнел (сравнить с контрольным раствором), отметьте в табл. наличие коагуляции знаком «+», в случае отсутствия ее - знаком «-». Дальнейшее разбавление электролита проводят аналогично. Так, разбавляя электролит и добавляя его по 1 мл в последующие пробирки с золем, найдите такую концентрацию электролита, при которой коагуляция уже не наблюдается. Концентрацию разбавленных растворов электролитов удобно выражать и записывать в табл. (графа С) в виде дроби в соответствующей степени, например:1)  ; 2)
; 2) 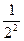 ; З)
; З)  и т.д.
и т.д.
|
|
|
Как уже говорилось ранее, та минимальная концентрация электролита, при которой наблюдается коагуляция золя, называется порогом коагуляции данного электролита. Ее величину находят для каждого электролита и записывают в таблицу 24 (порог коагуляции для СаС12 и K2SO4 определяют так же, как и для КС1). По величине порогов коагуляции устанавливают ионы-коагуляторы. Затем вычисляют коагулирующую силу иона-коагулятора, условно принимая коагулирующую силу одновалентного иона равной единице. Коагулирующую силу двухвалентного иона (S) вычисляют по формуле: S =  .
.
Пример: если С1= 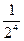 , а С2=
, а С2= 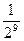 , то S=
, то S= 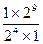 =25=32.
=25=32.
Таблица 24
Результаты расчета коагулирующей силы испытуемого золя.
| электролиты | испытуемый золь | ||
| ионы-коагуляторы | порог коагуляции | коагулирующая сила | |
| КС1 | |||
| СаС12 | |||
| K2SO4 |
Полученные данные показывают, что коагулирующая сила двухвалентного иона в десятки раз (в нашем случае в 32 раза) больше коагулирующей силы одновалентного иона.
На основании полученных данных определите знак заряда коллоидных частиц исследуемого золя и сделайте письменный вывод.
Задание 2. Коагуляция гидрофильных коллоидов действием дегидратирующих веществ.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1093; Нарушение авторских прав?; Мы поможем в написании вашей работы!