КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конструирование гальванического элемента. Химические источники тока
 |
Лабораторная работа №7.
Химические источники тока.
Каждый гальванический элемент состоит из двух электродов (окислительно-восстановительных пар), один из которых является поставщиком электронов (анод), а другой их принимает (катод). В гальванических элементах источником электрического тока является химическая реакция. Любая химическая реакция термодинамически разрешена, если Δ G < 0. Из соотношений Δ G = – nFE и Δ G ° = – nFE ° следует, что электрохимическая реакция, а в общем случае любая окислительно-восстановительная реакция может протекать самопроизвольно, если E > 0 или для стандартных условий E ° > 0.
Цель:
1. Научиться определять степень окисления.
2. Научиться распознавать типы окислительно-восстановительных реакций и выравнивать окислительно-восстановительные реакции.
|
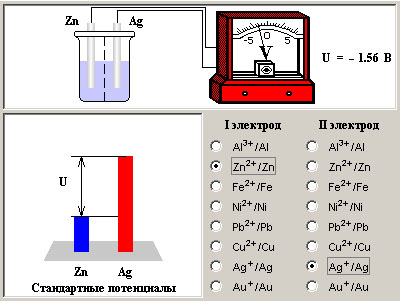
| Модель 7.4. Конструктор гальванических элементов. В этой модели вы сможете увидеть, как зависит ЭДС гальванического элемента от материалов, из которых сделаны электроды. Выбор материалов осуществляется нажатием одной из радиокнопок, соответствующих первому или второму электроду. Рядом с каждой из кнопок приведены восстановленная и окисленная формы данного вещества, которые возникают в реакциях, поисходящих в гальваническом элементе. Обратите внимание на то, что тот электрод, у которого стандартный потенциал больше (то есть он сложнее окисляется), выступает в гальваническом элементе положительным полюсом, а тот, у кого меньше, – отдает электроны и является «минусом». ЭДС гальванического элемента с одинаковыми электродами и равными концентрациями (активностями) ионов в растворе равен нулю. В модели это подтверждается нулевым напряжением на вольтметре в цепи такого элемента. В левом нижнем углу модели находится схема расчета ЭДС гальванического элемента. Она равна разности стандартных потенциалов электродов. Стандартным потенциалом в свою очередь называют ЭДС элемента, один из электродов которого сделан из исследуемого материала, а второй представляет собой омываемый газообразным водородом платиновый электрод (стандартный водородный электрод). Тогда ЭДС нашего элемента может быть вычислена, как алгебраическая сумма ЭДС двух гальванических элементов, последовательно соединенных между собой. Первый из них состоит из первого электрода исходного элемента и стандартного электрода, а второй – из стандартного электрода и второго электрода исходного элемента. Выполнить вопрос №29 из теста. |
ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
|
|
|

|

|
Пользуясь этими соотношениями и таблицей стандартных электродных потенциалов, можно предсказать возможность осуществления многих окислительно-восстановительных реакций.
В случае элемента Даниэля–Якоби (–)Zn¦Zn2+||Cu2+¦Cu(+)

|
Для нестандартных условий ЭДС элемента Даниеля–Якоби находится из разности электродных потенциалов, вычисленных по уравнению Нернста:
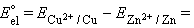
|
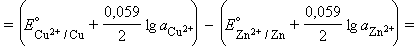
|
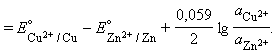
|
|
Для реакции

|

|
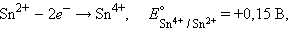
|
осуществляемой в элементе
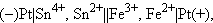
|
| (7.3) |
Величины электродных потенциалов определяются концентрациями (активностями) всех ионов, участвующих в окислительно-восстановительной реакции. Так, в элементе
|
|
|
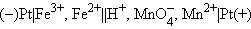
|
протекает реакция
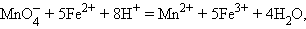
|
 
|
и уравнение Нернста для этого элемента имеет вид:

|
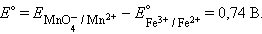
|
Обратите внимание, что в уравнении Нернста для реакции под знаком логарифма в числителе стоят концентрации исходных веществ, а в знаменателе – продуктов реакции в степенях стехиометрических коэффициентов.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 889; Нарушение авторских прав?; Мы поможем в написании вашей работы!