
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физико-химические свойства и роль воды в биосфере
|
|
|
|
ИЗМЕРЕНИЙ рН
Вода так распространена на Земле, что обычно считается безвредной инертной жидкостью, удобной для разных практик. В биосфере же, она составляет ~ 65 % массы клеток. Т.о., лишь около 1/3 их массы приходится на т. н. «сухое вещество». Известно, что высокая электроотрицательность атома О и низкая – Н, делает химически стабильные молекулы воды диполями, способными к образованию Н-связей и, реже, к диссоциации на протон (Н+) и гидроксил (ОН-). Это так отличает свойства воды от молекул с близкой массой: Н2, СН4, NH3, СО2 и низших органических растворителей, что вызывает ряд дискурсов = логических цепей физико-химических и биологических следствий (рис. 2.1).

Рис. 2.1. Биологические следствия структуры и свойств воды
Обратимая диссоциация молекул воды вызывает появление в ней ионов Н+ и ОН-, как и все ионы, покрытых многослойными ги-дратными оболочками. Хотя при 25 С, ионизируется лишь одна из 107 ее молекул, эта слабая склонность к ионизации делает настолько существенной роль Н+ и ОН- в физико-химических и биологических процессах, что ее выражают количественно: ионным произведением воды (Кw), численно равным 1,0 . 10-14. При равенстве концентраций Н+ и ОН-, в более чистой, чем дистиллят воде, раствор считают нейтральным, а его рН = 7. Этот показатель возник из выражения: рН = lg1/[H+] = -lg [H+], где –lg = р. Как видно из схемы (рис. 2.2) в кислом и щелочном диапазонах, сдвиги концентраций Н+ и ОН- всегда взаимозависимы = реципрокны, но, т.к. шкала рН логарифмическая, то ее сдвиг на 1 соответствует изменениям концентрации ионов в 10 раз!
Рис. 2.2. Примеры величин рН обще-распространенных жидкостей
(Ленинджер, 1985) 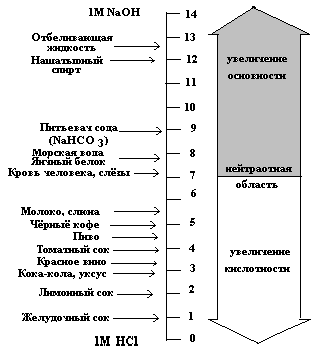
| Вода – значительно лучший растворитель, чем другие известные жидкости. В ней растворяются, как сильные кислоты и основания = В, так и кристаллические решетки многих солей, а также, частично диссоциирующие ионо-генные группы слабых органических кислот, В: аминов, амидов, азотистых гетероци-клов и их полимеров. Количество электролитов в растворе выражают их молекулярной массой: ммоль/л или способностью соединяться с разноименными ионами: мэкв/л. |
В последнем случае, мэкв анионов и катионов всегда равны. В воде также растворимы электронейтральные оксосоединения диаметром 0,3-0,5 нм, включая низшие альдегиды, кетоны и спирты, вплоть до олигоз.
|
|
|
Еще один класс растворимых в воде веществ – амфипатиче-ские = дифильные молекулы, имеющие наряду с полярными = ги-дрофильными и неполярные = гидрофобные группы. Их простейшая модель – мыла, то есть натриевые и калиевые соли высших (n = 12-22 С) жирных кислот, молекулы которых, на схемах обычно изображают «хвостатым» кружком, символизируя, соответственно,  полярную головку и, термодинамически выгодную, растянутую конформацию углеводородной цепи. В водных растворах, их полярные головы ориентированы наружу для образования Н-связей с молекулами воды. Напротив, неполярные хвосты скрыты внутри сферических агрегатов = мицелл, где контактируют между собой с помощью гидрофобных взаимодействий. Такая структура позволяет мицеллам иметь переменный состав и относительно крупные размеры, придавая их коллоидным растворам мутность мыла, непрозрачность молока или млечных соков растений. Важно отметить, что мицеллы обычно играют транспортную роль в межклеточных пространствах и сосудах, тогда как основные коллоиды клеток – структурированные растворы молекул белков и РНК, как основных типов «молекулярных машин», имеют средний диаметр 4-10 нм.
полярную головку и, термодинамически выгодную, растянутую конформацию углеводородной цепи. В водных растворах, их полярные головы ориентированы наружу для образования Н-связей с молекулами воды. Напротив, неполярные хвосты скрыты внутри сферических агрегатов = мицелл, где контактируют между собой с помощью гидрофобных взаимодействий. Такая структура позволяет мицеллам иметь переменный состав и относительно крупные размеры, придавая их коллоидным растворам мутность мыла, непрозрачность молока или млечных соков растений. Важно отметить, что мицеллы обычно играют транспортную роль в межклеточных пространствах и сосудах, тогда как основные коллоиды клеток – структурированные растворы молекул белков и РНК, как основных типов «молекулярных машин», имеют средний диаметр 4-10 нм.

Рис. 2.3. Схема влияний рН раствора на свойства и поведение биомолекул и агрегатов
|
|
|
Среди биомолекул нередки соли, а слабые кислоты и В, встречаются гораздо чаще сильных. Поэтому на рис. 2.3 дана схема дис-курса влияний величины рН растворов на структуру и активность ионогенных групп растворенных веществ. Очевидно, что эти воздействия так велики, что в лабораторной практике, за грубый критерий чистой воды принято ее сопротивление < 4 Ом. В биохимии и смежных практиках, измерения рН – одна из самых частых и важнейших процедурподготовки к анализам.
Поскольку вода для клеток не только наполнитель и основной растворитель, но и реакционная среда, она находится в них в двух формах: свободной (до 95 %) и связанной с фибриллярными структурами цитоскелета и пр. (4-5 %). Большинство биохимических ре-акций в водных растворах происходит между полярными молекулами, причем свободная вода может быть, как их участником, так и продуктом. Но, т. к. основой гидратации и растворения всех молекул служит изменение Н-связей водных кластеров, оно сдвигает и 4 важнейших физических константы воды: температуры замерзания и кипения, давление пара над раствором и осмотическое давление. Так как знание концентраций растворов позволяет предсказать количественные сдвиги этих констант, их объединяют понятием кол-лигативные = взаимосвязанные свойства. Именно они и позволяют водным видам существовать при температурах ниже 0 С!
До недавнего времени считалось, что из-за своих малых размеров, молекулы воды могут «проскальзывать» в клетки между сравнительно крупными молекулами мембранных фосфолипидов. Но, в 1988 г. Питер Эгр (Peter Agre) с коллегами выделил из мембран эритроцитов и проксимальных почечных канальцев, а позже подробно охарактеризовал мембранный белок-канал, названный аквапорин-1 (AQP1). Его тетрамер и образует полярную пору, способную проводить 3·109 молекул воды/с. Как теперь известно, аква-порины – обширное семейство белков всех без исключения плазматических мембран = ПМ и жестких клеточных оболочек = стенок прокариот, простейших, грибов и растений. Их физиологическая роль особенно заметна в таких функциях клеток, как поддержание осмотического давления, всасывание воды клетками корней растений и ее реабсорбция почкой животных, фильтрующих у человека ~150-200 л воды/сутки.
|
|
|
Поэтому в первом приближении, у многоклеточных организмов различают 2 водных пространства = компартмента: внутри- и внеклеточное. Первое из них относительно постоянно, т.к. ограничено ПМ, удерживающей в клетке большинство ее компонентов. Напротив, количество внеклеточной воды сильно зависит от возраста, пола и числа сравнительно бедных ею, белых и бурых жировых клеток, соответственно липо- и адипоцитов. Поэтому рост количества жировых клеток снижает содержание воды у многоклеточных животных. В связи с репродуктивной ролью, в массе тела самок на 5-10 % больше жира, чем у самцов и, соответственно – меньше воды (табл. 2.1).
Таблица 2.1
Динамика содержания воды в массе тела людей
(По М. М. Горн и др., 2000)

Из таблицы 2.2 видно, что перемещение растворенных в воде веществ основано на физико-химических принципах. Но их проявления сильно зависят, как от размеров и степени полярности самих биомолекул, так и от свойств гидрофобных биомембран и, таких надклеточных структур, как стенки капилляров и слои эпителиев, объединяемых понятиями гистогематических барьеров и барьерной функции.
Таблица 2.2
Основные механизмы перемещения молекул водных растворов в клетках и надклеточных системах
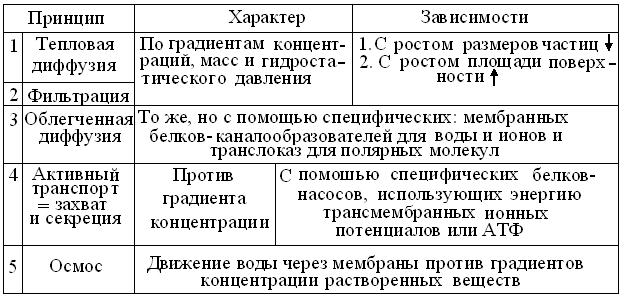
Очевидно, что избирательная = селективная проницаемость каналов транспорта молекул воды и порядка 50 типов ионных каналов, защищает все клетки от внешних воздействий, в то же время обеспечивая их связь с внешней средой и такие важные процессы, как создание мембранных потенциалов, секреция, мышечное сокращение и нейронная сигнализация. С нарушениями структуры и функций канальных белков связаны многие, в том числе, пока неизлечимые болезни. За фундаментальные открытия, связанные со структурой и функцией этих молекулярных машин, Нобелевская премия 2003 г. по химии присуждена Р. Мак-Киннону (Roderick MacKinnon) и П.Эгру (Peter Agre). По мнению экспертов, доказательства роли каналов сравнимы с достижением Уотсона и Крика, предложивших модель структуры ДНК.
Кроме транспортных механизмов клетки (табл. 2.2) и характера распределения их белков в ПМ, на проницаемость тканей для воды и ионов неизбежно влияют форма и плотность расположения клеток, выраженность у них полюсов, базальных мембран и межклеточных контактов. Крайними примерами этих свойств могут служить одиночный, веретенообразный фибробласт и гематоэнце-фалический барьер, с максимально известной плотностью расположения эндотелиоцитов.
|
|
|
Комбинации этих свойств в разных тканях, обеспечивающие надежность питания, межклеточной сигнализации и выведения из клеток конечных метаболитов, вынуждают различать у позвоночных 3 типа внеклеточных водных пространств:
1. Интерстициальная жидкость – водное окружение гликокаликса клеток, включая лимфу. У взрослых людей – 11-12 л. У новорожденных, относительно массы тела, ее примерно вдвое больше.
2. Внутрисосудистая жидкость – независимо от возраста ~7 % массы тела. От интерстициальной жидкости, пространство сосудов отграничено стенкой капилляров, образованной эндотелиоцитами и, секретированным ими же межклеточным веществом.
3. Трансцеллюлярные жидкости специализированных полостей тела: внутриглазная, спинномозгового канала, перикарда, плевры, синовиальная, пищеварительных соков и др. Их суммарный объем у человека – около 1 л. От интерстиция и внутрисосудистых пространств, их отделяют слои соответствующих эпителиев, обновляющих жидкости 6-8 раз в сутки с помощью механизмов секреции и реабсорбции.
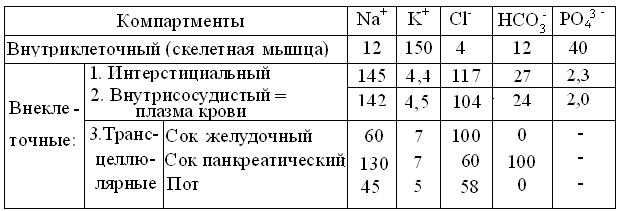
Для примера, в таблице 2.3 дано распределение важнейших ионов в водных компартментах позвоночных животных. Очевидно, что этот перечень можно продолжить ионами Ca2+, Mg2+, SO42- и низкомолекулярной органикой: глюкоза, лактат, цитрат, аминокислоты, мочевина и др., вплоть до белков, сконцентрированных в клетках и плазме крови.
Таблица 2.3
Распределение ионов (мэкв/л) в водных пространствах человека
(По М. М. Горн и др., 2000, с изменениями).
Известно, что меру способности раствора создавать осмотическое давление, влияя тем самым на скорость движения воды, называют осмоляльностью. Ее выражают в миллиосмолях на кг воды (мОсм/кг), где 1 осмоль содержит 6 х 1023 частиц. Отсюда осмо-ляльность также определяют, как меру концентрации жидкостей или соотношение растворенных веществ и воды. Другой способ оценки концентраций растворов – осмолярность, т.е. количество частиц в 1 л раствора (мОсм/л). Но, так как водные биожидкости относительно разбавлены, то разница между осмоляльностью и осмолярностью невелика и, эти термины часто применяют, как взаимозаменяемые.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1142; Нарушение авторских прав?; Мы поможем в написании вашей работы!