
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальная часть. Дополнительная литература
|
|
|
|
Дополнительная литература
4.2.1. Спектроскопические методы исследований в физиологии и биохимии. – Л.: Наука, 1987. – 204 с.
4.2.2. Физико-химические методы молекулярной биологии. – М.: Изд-во Моск. ун-та., 1978. – С. 65 – 95; 127 –173.
4.2.3. Бурштейн Э. А. Люминесценция белковых хромофоров. – М.: ВИНИТИ «Итоги науки и техники». Серия БИОФИЗИКА. – Т. 6, 1976. – 216 с.
4.2.4. Черницкий Е. А. Люминесценция и структурная лабильность белков в растворе и клетке. – Минск.: Наука и техника, 1972. – 280 с.
4.2.5. Эккерт Р. и др. Физиология животных. – М.: Мир, 1991. – Т. 1. Фоторецепторы. – С. 239 – 250.
4.2.6. Лакович Дж. Основы флуоресцентной спектроскопии. – М.: Мир, 1986. – 496 с.
4.3.1. Инструкция по эксплуатации фотоэлектроколориметра = ФЭКа, модели КФК-2
1. За 15 мин. до начала фотометрии, под контролем лаборанта или преподавателя, дежурный убеждается, что стрелка гальванометра находится в положении «механический 0», открывает крышку кюветного отделения прибора, вставляет его вилку в сетевую розетку и, тумблером на задней панели слева, включает прогрев ФЭКа.
2. Перед началом измерений, вращая рукоять светофильтра, на передней панели прибора слева, установить нужный диапазон светового потока = пучка.
3. Убедиться, что рукоять чувствительности прибора на передней панели справа, соответствует цветовому диапазону рукояти светофильтра.
4. Подготовить фотометрические кюветы нужной толщины, насухо протереть марлевой салфеткой их оптические грани и, убедиться в отсутствии на них пятен и др. грязи. ВНИМАНИЕ! Поскольку каждый ФЭК оснащен лишь одним набором кювет, изготовленных из полированного оптического стекла, пользоваться ими можно лишь над рабочим столом и брать рукой, только за боковые грани, оберегая от царапин и ударов.
|
|
|
5. Убедиться, что стрелка включенного гальванометра находится в положении «электрический 0».
6. Заполнить контрольную кювету дистиллятом или, указанным в соответствующей методике контрольным раствором, убедиться в отсутствии капель и потеков на ее оптических гранях, строго вертикально вставить ее в дальнее гнездо кюветодержателя и, рукояткой в центре передней панели ФЭКа, до упора ввести кювету в световой пучок.
7. В соответствии с п. 6, заполнить вторую кювету исследуемым раствором и вставить ее в свободное гнездо кюветодержателя, примерно на том же расстоянии от источника света. ВНИМАНИЕ! При анализе серии однотипных образцов, избегая излишних промывок кюветы, начинать фотометрию с наиболее разбавленных проб.
8. Закрыть крышку кюветного отделения до звяка шторки и, вращая на передней панели вверху рукояти грубой, а затем и тонкой настройки, установить стрелку гальванометра на 0 шкалы D = А. ВНИМАНИЕ! При положении стрелки между делениями шкалы - округлять цифру до целого значения.
9. Не открывая крышки кюветного отделения, переместить до упора рукоять кюветодержателя в противоположение, заменив тем самым в световом потоке, контрольную кювету исследуемой.
10. Убедиться, что стрелка гальванометра успокоилась и занести показания ФЭКа в протокол опыта.
11. Открыть крышку кюветного отделения, вынуть из кюветодержателя кювету с исследуемым раствором и, декантировать ее содержимое обратно в соответствующую пробирку. ВНИМАНИЕ! Для последующих измерений, во избежание потеков на стенках, кювету не переворачивать, а удерживая вверх дном, осушить ее торец фильтровальной бумагой.
12. При последующих измерениях, руководствоваться пп. 6-11 данной инструкции.
4.3.2. Определение концентрации гемоглобина (Hb) в крови
гемиглобинцианидным методом
Принцип: Основный буферный раствор разрушает эритроциты, а феррицианид калия K3[Fe(CN)6] = красная кровяная соль, окисляет до трёхвалентного состояния атом Fe2+ гема гемоглобина = Нb. Возникший гемиглобин (Нi), или, по старой номенклатуре - метгемоглобин, реагирует с ацетонциангидрином:
|
|
|
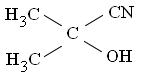 с образованием гемиглобинцианида, имеющего стабильный максимум абсорбции при λ 540-546 нм, пропорциональный содержанию Hb в пробе. Метод общепринят в мировой лабораторной прак-тике, как наилучший по сочетанию параметров. Нормальное содер-жание Нb в крови женщин составляет: 115 – 145 г/л, а мужчин: 132 – 164 г/л. Выпускаемые промышленностью моделигемоглобинометров, обычно основаны на том же принципе фотометрии, но имеют суженный диапазон, соответствующий максимуму А гемиглобинцианида.
с образованием гемиглобинцианида, имеющего стабильный максимум абсорбции при λ 540-546 нм, пропорциональный содержанию Hb в пробе. Метод общепринят в мировой лабораторной прак-тике, как наилучший по сочетанию параметров. Нормальное содер-жание Нb в крови женщин составляет: 115 – 145 г/л, а мужчин: 132 – 164 г/л. Выпускаемые промышленностью моделигемоглобинометров, обычно основаны на том же принципе фотометрии, но имеют суженный диапазон, соответствующий максимуму А гемиглобинцианида.
Ход определения: В маркированную пробирку внести точно 5 мл трансформирующего раствора, содержащего нужные пропорции буфера, феррицианида калия и ацетонциангидрина. Затем, с помощью полуавтоматического дозатора, туда же добавить 20 мкл крови (Разведение в 251 раз). Полученной смесью многократно промыть наконечник дозатора и тщательно перемешать раствор. Пробирку оставить в штативе не менее чем на 10 мин.
Декантировать пробу в кювету ФЭКа, толщиной 10 мм и при зеленом светофильтре, против трансформирующего раствора, измерить А. Рассчитать концентрацию гемоглобина (г/л) в крови по формуле: А . 367,7, занести результат в протокол и сделать выводы.
4.3.3. Определение количества эритроцитов в крови с помощью турбидиметрии
Принцип метода: Многократное разведение нативной крови с антикоагулянтом, изоосмотическим раствором с физиологическим рН, делает суспензию эритроцитов относительно стабильной и прозрачной. Это позволяет, при максимально возможной λ ФЭКа, сочетать минимум поглощения энергии света с его максимальным рассеянием, клетками соизмеримого диаметра.
Ход определения:
1. Подготовить в штативе ряд из 7 маркированных пробирок.
2. С помощью мерных пипеток, внести в первую пробирку точно 4 мл, а в остальные – по 2 мл 0,85 % раствора хлорида натрия = физиологический раствор, с рН = 7,36.
3. Полуавтоматическим дозатором на 20 мкл внести в первую пробирку 2 объема (40 мкл) цельной крови. Многократно промыть наконечник дозатора полученной суспензией, тщательно перемешивая ее.
|
|
|
4. С помощью мерной пипетки, перенести из первой пробирки во вторую точно 2 мл суспензии и снова, тщательно ее перемешать.
5. Повторять операцию «переката», перенося точно по 2 мл суспензии и тщательно перемешивая вновь полученную, из второй пробирки в третью, из третьей в четвертую и т.д. Из последней пробирки, 2 мл суспензии слить в отходы.
6. Вращая рукоять на передней панели ФЭКа слева, установить красный светофильтр и, соответственно пп. 2 и 3 работы 4.3.1, убедиться в соответствии положения рукояти его чувствительности на передней панели справа.
7. Начиная с самой разбавленной пробы (пробирка 7) поочередно декантировать содержимое пробирок в кювету толщиной 5 мм и, замерив их абсорбцию против дистиллята или физраствора, занести результаты в таблицу 4.4 протокола опыта.
Таблица 4.4
Анализ серии растворов

8. Рассчитать серии разведений крови, полученных методом «переката».
9. Вычертить график зависимости между разведением проб (абсцисса) и абсорбцией (ордината), определив на нем линейный отрезок разведений, пригодных для счета эритроцитов по степени мутности растворов.
10. Если параллельно, с помощью эталонной микроскопии в камере Горяева, подсчитать содержание эритроцитов в исходном образце крови и разведенных пробах, можно заполнить последнюю строку в таблице 4.4. Соответственно, внеся нужные поправки, удастся построить аналогичный разбавлению калибровочный график, таблицу или простую компьютерную программу, для автоматического счета эритроцитов в разбавленных образцах крови. В частности, так построена калибровочная таблица лаборатории, по которой можно определить содержание эритроцитов в 1 мкл и, соответственно, в 1 л крови исследуемого образца.
11. Сделать выводы из эксперимента, учитывая, что нормальное содержание эритроцитов в крови женщин: 3 – 4,5 х 1012/л, а мужчин: 4 – 5,5 х 1012/л.
12. Пара студентов, завершающая фотометрию, оставив открытой крышку кюветного отделения ФЭКа, тумблером на задней панели слева, выключает прибор и вынимает его сетевую вилку из розетки.
13. Слив растворы из кювет, тщательно вымыть их изнутри и снаружи дистиллятом и, оставить вверх дном на фильтре. После чего, убрать рабочее место и сдать его лаборанту.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 499; Нарушение авторских прав?; Мы поможем в написании вашей работы!