
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Занятие 7. Методы количественного анализа белков
|
|
|
|
Задания на дом
Вопросы для самоконтроля
6.4.1. С позиций биологии, определите понятие «ткань».
6.4.2. Какие разновидности биотканей вам известны?
6.4.3. Определите понятие «дифферон» и приведите их примеры.
6.4.4. Можно ли биохимические методы анализа назвать неразрушающими?
6.4.5. Чем различаются основные подходы к биохимическому анализу и в чем состоит залог его успеха?
6.4.6. В чем могут заключаться подготовительные операции при биохимическом анализе?
6.4.7. В каком температурном режиме хранят материал и выделяют биохимические препараты?
6.4.8. Почему нет единого алгоритма для выделения биомолекул?
6.4.9. Сформулируйте основные этапы препаративной биохимии.
6.4.10. Назовите основные этапы диагностической биохимии.
6.4.11. Какие способы разрушения тканей и клеток вам известны?
6.4.12. Почему ткани животных разрушать проще, чем клетки прокариот и ткани растений?
6.4.13. Какими приемами удаляют из гомогенатов недостаточно разрушенный материал?
6.4.14. Какие принципы могут лежать в основе разделения смеси биомолекул?
6.4.15. Какие факторы нужно учитывать при экстракции или осаждении биополимеров из смеси?
6.4.16. Что такое «высаливание» и зачем оно применяется?
6.4.17. Какие методы применимы для удаления или замены низкомолекулярных веществ в гомогенатах?
6.4.18. Что такое «молекулярные сита» и на каком принципе основано их применение? Назовите синонимы этого метода?
6.4.19. Почему различия в фазовых переходах сравнительно редко применяются к разделению биомолекул?
6.4.20. Какие методы разделения макромолекул основаны на разнице в их размерах?
6.4.21. Что такое хроматография и, какие ее разновидности вам известны?
6.4.22. Что такое «изоэлектрическая точка» и чем она отличается от понятия «изоэлектрическое состояние»?
|
|
|
6.4.23. Что вы знаете об электрофорезе и, чем он отличается от изоэлектрофокусирования?
6.4.24. Какие способы концентрирования растворов вам известны?
6.4.25. Как убедиться в гомогенности и нативных свойствах препарата?
6.5.1. При оформлении протокола и подготовке к занятию 7 объясните, почему основным источником информации для диагностики состояний животных и людей, чаще всего служит кровь? В чем вы видите недостатки и достоинства ее применения?
6.5.2. Объясните понятие «гематокрит» и его диагностические возможности.
6.5.3. Чем объяснить легкость выделения из крови эритроцитов и сложность выделения прочих форменных элементов?
6.5.4. Чем объяснить разницу выделенных объемов гемоглобина и «теней» эритроцитов?
6.5.6. Что вы знаете о происхождении и функциях белков плазмы крови?
6.5.7. Чем различаются понятия «плазма» и «сыворотка» крови?
6.5.8. В соответствии со схемой 6-3, рассчитайте для каждого этапа затраты материала и его разведение. Обдумайте, насколько целесообразна подобная схематизация для предстоящих работ?
6.5.9. Исходя из молекулярной массы триптофана – 204 Да и его содержания в СА – 0,58%, рассчитайте минимальную массу бычьего сывороточного альбумина = БСА.
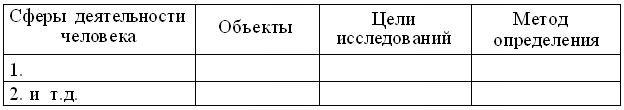
6.5.10. В соответствии с предложенным шаблоном, заполните таблицу, отразив известные вам сферы деятельности человека, связанные с методами определения количества белка:
6.5.11. Чем отличаются ферменты = энзимы = Е от небиологических катализаторов?
6.5.12. Какими методами изучают Е и, как измеряют их активность?
6.5.13. Что такое специфичность действия Е и в чем заключаются стадии биокатализа?
6.5.14. Что вы знаете о номенклатуре Е?
6.5.15. Попытайтесь суммировать роль ионов металлов и витаминов для биокатализа.
6.5.16. Объясните принцип действия конкурентных ингибиторов Е и степень их обратимости.
|
|
|
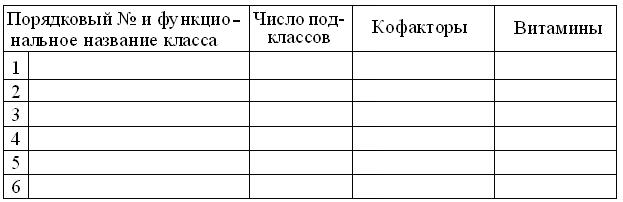
6.5.17. В соответствии с шаблоном, создайте и заполните таблицу классификации Е и их кофакторов:
6.5.18. Исходя из природы Е, объясните зависимости скоростей катализа от: рН среды, температуры, присутствия их активаторов и ингибиторов.
6.5.19. Объясните понятия: гомеостаз, компартментация, изоферменты и органоспецифичность Е.
6.5.20. Приведите примеры мультиферментных комплексов и метаболических путей, как способов организации работы Е в клетках.
6.5.21. Что вам известно о принципах аллостерической регуляции путей метаболизма, веществах-регуляторах и олигомерной структуре ключевых Е?
6.5.22. Объясните роль ковалентных модификаций Е в образовании ферментных каскадов на примерах внутриклеточных реакций фосфорилирования/дефосфорилирования и гликозилирования, а также избирательного протеолиза при свертывании крови и пищеварении.
6.5.23. Что вы знаете о семействах и роли в жизнедеятельности клеток белков теплового шока = БТШ = HSP, шаперонов и шаперонинов, циклинов и циклинзависимых протеиназ?
6.5.24. Попытайтесь создать схему применения Е и их ингибиторов в качестве индикаторов состояний, лекарств и пестицидов, аналитических реактивов и инструментов модификации молекул в различных сферах деятельности людей.
7.1. Общие замечания. Известно, что белки составляют половину и более сухой массы большинства клеток. Пластичность их полипептидной структуры позволяет белкам играть роль главных «молекулярных машин» в любой клетке и организме. Наконец белки – важнейший источник азота в питании, а, следовательно, росте и развитии консументов. Поэтому определение белка играет первичную = опорную роль во всех количественных исследованиях по энзимологии и биологии клеток, служит основой оценки физиологии и патологии организмов и их популяций, а также – важнейшим критерием оценки качества = эффективности пищевых цепей.
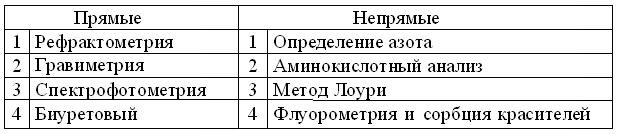
Соответственно задачам и возможностям лабораторий, методы измерения концентрации белков (табл. 7.1) многочисленны и разнообразны. Очевидно, что рефрактометрия (лат. Refractus – преломление) позволяет быстро и просто определять процентные концентрации белка в двухкомпонентных растворах. Гравиметрия – зависит от чувствительности лабораторных весов и требует чистого препарата, высушенного до постоянной массы. Принцип и формула расчета фотометрии белков в УФ, уже приводились в таблице 4.3.
|
|
|
Таблица 7.1
Методы измерения концентрации белков
До 70-х гг. прошлого века, наиболее точным (10-5 г/л), считалось определение белка по количеству азота. Исходя из того, что в подавляющем большинстве белков, за исключением гистонов и протаминов, содержание азота близко к 16 %, считалось достаточным умножить найденную величину на эмпирический коэффициент 6,25 и, получить содержание белка в препарате. Однако, необходимость минерализации препарата в серной кислоте и последующее определение аммиака, занимали часы-сутки. Из-за длительности и трудоемкости этих процедур, сейчас этот метод применяют редко. По близким причинам, измерение концентраций белка на основе анализа аминокислот, используют лишь в специализированных лабораториях.
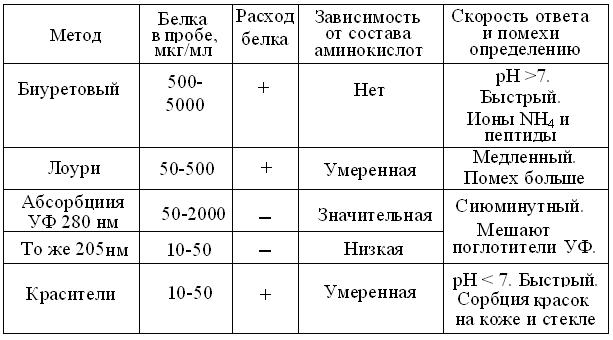
С 50-х гг. ХХ в., чаще всего в биохимической литературе цитировали работу Lowry и соавторов, предложивших измерять концентрации белков сочетанием биуретовой реакции с реактивом Фолина-Чиокалто (1927), дающим интенсивную темно-синюю окраску с тирозином, фенилаланином и, меньше с такими аминокислотами, как Три, Гис, Цис. К сожалению, его линейность, сохраняется лишь в узком диапазоне концентраций. Большинство модификаций этой методики сводится к попыткам устранить влияние специфических реагентов, применявшихся при выделении белков. В последние годы появились методы связывания красителей и флуорометрии, если в белке имеется, или, без потери нативных свойств, в него вводится соответствующий маркер. Достоинства и недостатки этих методов сведены в таблицу 7.2.
Таблица 7.2
Сравнение достоинств и недостатков методов измерения количества белка (По Р. Скоупс, 1985 с изменениями)
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 829; Нарушение авторских прав?; Мы поможем в написании вашей работы!