
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы слабых электролитов. Пример 1рассчитайте степень диссоциации, рн, с(н3о +) и с(он-) в водном растворе уксусной кислоты с концентрацией 0,1моль/л
|
|
|
|
Пример 1 Рассчитайте степень диссоциации, рН, с(Н3О +) и с(ОН-) в водном растворе уксусной кислоты с концентрацией 0,1моль/л. рКа(СН3СООН) = 4,76.
Решение:
Протолитическое равновесие: CH3COOH +H2O = CH3COO- + H3O+
Сопряжённые пары: кислота СН3СООН и сопряжённое с ней основание СН3СОО-,
Основание Н2О и сопряжённая с ним кислота Н3О+.
Константа протолитического равновесия- константа кислотности уксусной кислоты
Ка = 
Для слабых электролитов ионная сила мала и коэффициент активности можно принять равным 1. Тогда: Ка = 
Поскольку с(СН3СОО-) =с(Н3О+) предыдущее выражение можно представить в виде:
Ка = 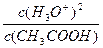 ; Ка·с(CH3COOH) = c(H3O+)2. Прологорифмировав левую и правую часть, получим: рКа – lgc(CH3COOH) = 2pH
; Ка·с(CH3COOH) = c(H3O+)2. Прологорифмировав левую и правую часть, получим: рКа – lgc(CH3COOH) = 2pH
Равновесная концентрация уксусной кислоты равна исходной за вычетом концентрации, подвергнутой протолизу, т.е. сисх.- с(Н3О+)[или с(СН3СОО-), поскольку они равны]
Для слабых электролитов, в растворах которых концентрация ионов очень мала можно принять
сисх – с(Н3О+)  сисх.
сисх.
Тогда: 4,76 – lg0,1 = 2pH. pH = 2,88. pOH = 14 – 2,88 = 11,12.
c(H3O+) =1,32·10-3. c(OH-) = 7,59·10-12
Степень диссоциации 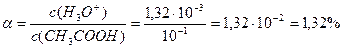
Пример 2. Рассчитайте [HCO3-] и [CO32-] в 0,01М растворе угольной кислоты, если рН этого раствора равен 4,5. Ка1 = 4,45∙10-7 Ка2 =4,69∙10-11 .
Решение:
Протолитические равновесия:
1 ступень: H2CO3 + H2O = HCO3- + H3O+
2 ступень: HCO3- + H2O = CO32- + H3O+
pH = 4,5. Отсюда [H3O+] = 3,16∙10-5 моль/л
Константа протолиза(константа кислотности) по первой ступени:
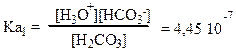
Отсюда [HCO3-] = 4,45∙ 10-7 ∙ 10-2 / 3,16∙10-5 = 1,41∙10-4 моль/л.
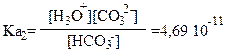
Отсюда [CO32-] = 4,69∙10-11 ∙ 1,41∙10-4 / 3,16∙10-5 = 2,09∙10-10 моль/л.
Пример 3. Вычислите концентрационную константу кислотности уксусной кислоты в водном растворе Mg(NO3)2 с концентрацией соли 0,05 моль/л, если рКо = 4,75.
Решение:
Термодинамическая константа кислотности уксусной кислоты:
|
|
|
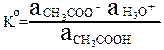
Концентрационная константа кислотности уксусной кислоты:

аCH3COO- = fCH3COO- ∙[CH3COO-]; aH3O+ = fH3O+ [H3O+]; aСH3COOH = fCH3COOH∙[CH3COOH]
Отсюда: Kо = Kc fCH3COO- fH3O+ / fCH3COOH∙, но поскольку для уксусной кислоты коэффициент активности практически равен 1, то Kc = Kо / fCH3COO- fH3O+
Ионная сила раствора в основном определяется сильным электролитом-солью:
I = 0,5(0,05∙ 22 + 0,1∙1) = 0,15.
В соответствии с таблицей: fCH3COO- = 0,79, а fH3O+ = 0,85.
Если рКо = 4,75, то Ко = 1,78∙10-5
Тогда Кс = 1,78∙10-5 / 0,79∙0,85 = 2,65∙10-5
Пример 4. Рассчитайте рН 0,01М раствора молочной кислоты. Ка = 1,4 ∙ 10-4
Решение:
Протолитическое равновесие:
CH3CH(OH)COOH + H2O = CH3CH(OH)COO- + H3O+
Для слабых электролитов, у которых степень протолиза > 5%,
уже нельзя считать концентрацию молекул, не подвергнутых протолизу, равной исходной концентрации электролита. Поэтому для молочной кислоты:
[CH3CH(OH)COOH] = [CH3CH(OH)COOH] исх. - [H3O+]
Тогда: Ka = [H3O+] [CH3CH(OH)COOH] / [CH3CH(OH)COOH] =
[H3O+]2 / [CH3CH(OH)COOH] исх. – [H3O+]
[H3O+]2 + Ka[H3O+] - Ka[CH3CH(OH)COOH] исх. = 0
 |
[H3O+] = 0,5 (-Ka + √ Ka2 + 4Ka[CH3CH(OH)COOH] исх.;
 [H3O+] = 0,5 (-1,4 ∙10-4 + √ (1,4 ∙ 10-4)2 + 4 ∙ 1,4 ∙10-4 ∙ 10-2) = 1,12∙ 10-3 моль/л..
[H3O+] = 0,5 (-1,4 ∙10-4 + √ (1,4 ∙ 10-4)2 + 4 ∙ 1,4 ∙10-4 ∙ 10-2) = 1,12∙ 10-3 моль/л..
pH = 2,9
Пример 5. Рассчитайте рН раствора HCN с концентрацией 10-6 моль/л. Ка = 6,2 ∙10-10
Решение:
Для слабых электролитов с концентрацией < 10-4 моль/л, у которых константа протолиза < 10-8
необходимо учитывать автопротолиз воды.
Протолитическое равновесие:
HCN + H2O = CN- + H3O+
Уравнение электронейтральности: [H3O+] = [CN-] + [OH-];
[OH-] = Kw/ [H3O+];
Ka = [H3O+] [CN-] / [HCN]; [CN-] = Ka [HCN] / [H3O+];
Так как очень слабая, можно считать: [HCN] = [HCN] исх.
Тогда: [H3O+] = Ka [HCN]исх. / [H3O+] + Kw/[H3O+];
[H3O+]2 = Ka [HCN]исх. + Kw;
 |  |
[H3O+] = √ Ka [HCN]исх. + Kw = √ 6,2 ∙ 10-10 ∙ 10-6 + 10-14 = 1,03 ∙ 10-7 моь/л .
pH = 6,99.
Пример 6. Рассчитайте рН раствора ацетата натрия с концентрацией 0,1 моль/л, а также степень протолиза(гидролиза) этой соли. Ка(СН3СООН) = 1,75 ∙10-5.
Решение:
Протолитическое равновесие: CH3COO- + H2O = CH3COOH + OH-
|
|
|
Константа протолиза(константа основности иона ацетата):
Kb = [CH3COOH] [OH-] / [CH3COO-]
[CH3COOH] = [OH-]
а) Для приближенных расчетов можно считать, что [CH3COO-] = [CH3COO-] исх.
б) Для точных расчетов: [CH3COO-] = [CH3COO-] исх. - [OH-]
Kb = Kw/ Ka = 10-14 / 1,75 ·10-5 = 5,75 ·10-10
а) Kw/Ka = [OH-]2 / [CH3COO-]; [OH-]2 = Kw/Ka [CH3COO-];
2pOH = -lgKw + lgKa - lg[CH3COO-] = -lg10-14 + lg1,75 ∙10-5 - lg 0,1 = 10,24.
pOH = 5,12. pH = 14 - 5,12 = 8,88.
б) Kw/Ka = [OH-]2 / ([CH3COO-] исх. – [OH-]);
[OH-]2 = Kw/Ka ([CH3COO-] исх. – [OH-]);
[OH-]2 = 5,75 · 10-10 (0,1 – [OH-]); Пусть [OH-] = x.
x2 + 5,75·10-10 x - 5,75 ·10-10 · 0,1 = 0;
x = 7,6 ·10-6; [OH-] = 7,6 ·10-6 моль/л; рОН = 5,12. pH = 8,88.
Степень гидролиза соли: h = [OH-] / [CH3COO-] исх. = 7,6 ·10-6 / 10-1 = 7,6 ·10-5 = 0,0076%.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1153; Нарушение авторских прав?; Мы поможем в написании вашей работы!