
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи для самостоятельного решения. 1. Дайте определение понятиям: «произведение растворимости», «растворимость»
|
|
|
|
1. Дайте определение понятиям: «произведение растворимости», «растворимость».
2. Вычислите произведение растворимости хромата серебра, если в 500 мл воды при 25°С растворяются 0,011 г Аg2 СгО4.
3. Произведение растворимости АgС1 равно 1,810-10 Вычислите растворимость соли (моль/л и г/л) в воде и 0,01М КС1. Коэффициенты активностей ионов принять равными 1.
 4. Смешали 10 мл 0,01М раствора СаС12и 40 мл 0.01М раствора оксалата аммония (NH4)2C2O4. Выпадет ли осадок оксалата кальция, если Копр(CaC2O4) =2∙10-9?
4. Смешали 10 мл 0,01М раствора СаС12и 40 мл 0.01М раствора оксалата аммония (NH4)2C2O4. Выпадет ли осадок оксалата кальция, если Копр(CaC2O4) =2∙10-9?
5. В раствор, содержащий 0,01 моль/л BaCl2, и 0,01 моль/л SrCl2, медленно добавляют раствор сульфата натрия. Какой осадок выпадет первым,
если Копр(BaSO4) =1,1 ∙10-10; Копр(SrSO4)=3,2 ∙ 10-7?
Строение атома
Для описания химических свойств элементов и соединений необходимо знать строение электронных оболочек атомов. Электрон - особая структура, имеющая отрицательный заряд, и обладающая свойствами как частицы, так и волны. Описание движения электрона в поле притяжении ядра атома с помощью классической механики невозможно. Для этого используются методы теории вероятности, общей теории электромагнетизма и квантовой механики.
Существует так называемая волновая функция ψ, связывающая вероятность положения электрона в пространстве с его полной энергией. Соответствующее волновое уравнение Шредингера связывает волновую функцию ψ и полную энергию электрона, потенциальную энергию электрона и его массу. Важно, что квадрат волновой функции | ψ| 2 пропорционален вероятности нахождения электрона в определенной области пространства вблизи атома. Такая область получила название атомная орбиталь (АО). Графический образ – квадрат.



Понятие АО вытекает из решения волнового уравнения и определяется как область пространства вблизи атомного ядра, вероятность нахождения электрона в которой максимальна и составляет 90-95%. Данная область имеет определенную форму, размеры и энергию, которые определяются набором 3-х т.н. квантовых чисел (n, l, m l), вытекающих из решения волнового уравнения.
|
|
|
n – главное квантовое число которое последовательно принимает значения 1,2,3,4 …;
l – орбитальное квантовое число которое при n=const последовательно принимает целочисленные значения от 0 до (n-1);
m l – магнитное квантовое число, которое при n, l = const последовательно принимает целочисленные значения от (-l) до (+l), включая 0;
ms – спиновое квантовое число,которое имеет два значения – либо (+1/2) либо (-1/2).
Главное квантовое число n – определяет размеры и потенциальную энергию атомной орбитали(АО). Совокупность АО с постоянным n определяет энергетический уровень (ЭУ).
Орбитальное квантовое число l - «ответственно» за форму АО.. Орбитальному числу l = 0 отвечают s –орбитали, числу l =1- р -орбитали, числу l =2 - d -орбитали. Совокупность АО с постоянным значением l при данном n образует энергетический подуровень (ЭПУ).
Магнитное квантовое число m l – определяет ориентацию орбитали в пространстве.
Так, для p - энергетического подуровня (l =1) значения ml следующие: -1, 0, +1. Таким образом, можно определить число АО на данном энергетическом подуровне, которое равно 2 l + 1.
Тогда, на s –ЭПУ - 1 АО, на p –ЭПУ – 3 АО, а на d –ЭПУ -5 АО.
Набор трёх квантовых чисел характеризует атомную орбиталь – объём пространства, в котором электрон может находиться в атоме. Согласно принципу запрета Паули атомная орбиталь не может принять более чем два электрона и обязательно с разнонаправленными спинами
(обозначены стрелками):
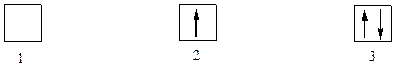
1 – вакантная атомная орбиталь; 2- атомная орбиталь с неспаренным электрпоном;
3- атомная орбиталь с электронной парой
|
|
|
Электрон в атоме имеет собственный вращательный момент механического движения, который также квантуется. В зависимости от знака вращения соответствующее квантовое число (ms) – спиновое - имеет два значения +1/2 и -1/2. Следовательно, электрон в атоме описывается набором 4-х квантовых чисел, три из которых относятся к атомной орбитали, которую он занимает и собственное спиновое квантовое число.
Принципы заселения ЭПУ электронами.
1. Принцип минимума энергии. Наибольшая устойчивость электронной системы атома соответствует минимуму полной энергии для незаселенных состояний.
2. Принцип Паули. В атоме не может быть 2-х электронов с одинаковым набором всех четырех квантовых чисел. Другими словами, на АО максимально может разместиться не более 2-х электронов с противоположным значением спиновых чисел.
3. Правило Гунда. При заселении ЭПУ суммарное спиновое число для электронов должно быть максимально положительным.
4. Правило Клечковского. Заселение ЭПУ происходит от меньших значений суммы (n+l) к большим значениям (n+l). При одинаковых значениях этой суммы первым заполняется ЭПУ с меньшим значением главного квантового числа n.
Тогда последовательность заселения пустых ЭПУ представляется такой
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s и т.д.
Существует два основных вида составления электронных состояний нейтральных атомов или простых ионов.
Электронная формула (электронная конфигурация). Для нейтрального атома число электронов равно заряду ядра этого атома. Эти электроны, в соответствии с принципами заселения, размещаются на вакантных ЭПУ и записываются слева направо в порядке увеличения энергии ЭПУ. Так, для атома кремния порядковый номер 14. Тогда электронная формула нейтрального атома будет иметь вид: Si 1s22s22p63s23p2. Часто используется сокращенная запись, в которой невалентные электроны обозначаются через устойчивую конфигурацию предшествующего благородного газа. Для кремния это неон. В таком случае можно записать: Si [Ne] 3s23p2.













 Второй формой записи электронных состояний является энергетическая диаграмма, которая отражает различие в энергии энергетических подуровней и степень их заполнения электронами.
Второй формой записи электронных состояний является энергетическая диаграмма, которая отражает различие в энергии энергетических подуровней и степень их заполнения электронами.

Электронные конфигурации простых катионов и анионов получаются путем удаления или добавления определенного числа электронов на валентные АО. Так, для хлора электронная формула нейтрального атома1s22s22p63s23p5. Для аниона Cl- добавляется один электрон 1s22s22p63s23p6. Для степени окисления хлора +5 необходимо удалить 5 электронов с р -подуровня: 1s22s22p63s23p0.
|
|
|
При составлении электронных формул d-элементов нужно учитывать тот факт, что при наличии хотя бы одного электрона на (n-1)d -ЭПУ, энергия этого подуровня становится меньше, чем энергия ns валентного подуровня. Соответственно, при образовании катионов первыми будут «уходить» электроны именно с ns -подуровня. Так, сокращенная электронная формула нейтрального атома титана: Ti[Ar]3d24s2, для Ti (+2) формула иона будет следующей: [Ar]3d24s0.
Для некоторых элементов оказывается энергетически выгодным переход электронов с ns ЭПУ на (n-1)d энергетический подуровень. В частности, такая ситуация реализуется для атомов хрома, молибдена, меди, серебра и т.д. Например, хром имеет следующую конфигурацию валентных ЭПУ: [Ar]3d54s1.
Изоэлектронные состояния реализуются для близко расположенных атомов в Периодической таблице в различных степенях окисления, при которых в них содержится равное число электронов. Так, атом водорода в степени окисления (-1) имеет электронную формулу 1s2. Такую же конфигурацию будут иметь и атом гелия, и катионы лития(+1), бериллия(+2), бора (+3).
Геометрические и энергетические характеристики атомов.
При движении по периоду слева направо возрастает как заряд ядра атомов, так и суммарный заряд электронов. Следовательно, сила притяжения между ядром и электронами, в соответствии с законом Кулона, возрастает, тогда валентные ЭПУ будут «сжиматься» и размеры атомов будут уменьшаться. В таком случае затраты энергии для отрыва валентных электронов будут увеличиваться. Ранее величина, характеризующая энергию отрыва наиболее слабо связанного электрона от нейтрального атома, носила название первый потенциал ионизации (I1)и измерялась в электронвольтах (эВ/атом). В настоящее время используется понятие – энергия ионизации (Ei) - энергия, затрачиваемая для образования 1 моль однозарядных катионов из нейтральных атомов и измеряемая в кДж/моль. Энергия ионизации всегда затрачивается, т.е. является эндотермическим процессом. Естественно, обе этих величины будут увеличиваться по периоду, хотя и не вполне монотонно.
|
|
|
С этих же позиций кажется вполне очевидным, что при движении сверху вниз по группе размеры атомов увеличиваются, а энергия ионизации уменьшается.
С другой стороны, атомы некоторых элементов могут принимать электроны с образованием анионов. Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону (в электронвольтах на атом) или энергией сродства к электрону (в кДж/моль). Этот эффект может быть как эндотермическим, так и экзотермическим.
Полусумма энергий ионизации и сродства к электрону характеризует меру способности атома смещать к себе электронную плотность от других атомов. Эта величина называется электроотрицательностью Обычно электроотрицательность выражается в условных единицах. Минимальные значения (0,7-0,8) соответствуют щелочным металлам, максимальные – активным неметаллам (у фтора 4,1 у кислорода 3,5). Cлева направо по периоду значения χ увеличиваются, а сверху вниз по группе уменьшаются.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 506; Нарушение авторских прав?; Мы поможем в написании вашей работы!