
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Начало термодинамики
|
|
|
|
Энтропия идеального кристалла при абсолютном нуле S=0.
Идеальный кристалл- в котором атомы занимают узлы кристаллической решётки в строгом соответствии с геометрическими законами.
Абсолютная и стандартная энтропия рассчёт
Предположим, что температура 1 моль вещества при постоянном давлении увеличивается от абсолютного 0, где вещество находится в состоянии идеального кристала до некоторой температуры Т, где вещество находится в состоянии идеального газа. При этом осуществляются следующие превращения.
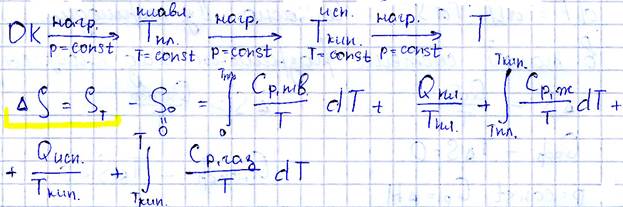
Энтропия вычисленная по данному уровню называется абсолютной энтропией чистого вещества при заданной температуре и атмосферном давлении.
Т=298 стандартная энтропия при данной температуре
Абсолютная и стандартная энтропии
энтропия, — физическая величина, используемая для описаниятермодинамической системы
Абсолютное значение энтропии, полученное при интегрировании dS = δQ/T известно с точностью до постоянной интегрирования (S0):
Значение этой постоянной устанавливается третьим законом термодинамики:
При нулевой абсолютной температуре энтропия любых веществ, находящихся в рав-
новесном состоянии, имеет одно и то же значение, не зависящее от фазового со-
стояния вещества. В изотермических процессах, происходящих при T = 0, энтропия
не зависит ни от обобщенных сил, ни от обобщенных координат.
Стандартная энтропия значение энтропии при стандартных условиях Т=293К
Скорость,порядок, молекулярность
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени.
V= +- 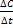
Влияние концентрации на скорость реакции описывается законами действующих масс.
|
|
|
Скорость реакции пропорциональны произведению концентрации реагирующих веществ, взятых в степенях равных стехиометрическим коэфициентам
ɑA+ɓB+...+ɨI→
V=k* 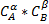 *…..*
*…..* 
k- константа скорости химической реакции
Сумма показателей степеней в выражении действующих масс - общий порядок реакции
В простых реакциях протекающих в одну стадию порядок реакции целое число.(1,2 реже 3)
в сложных реакциях, протекающих в несколько стадий порядок реакции может быть равен нулю,дроби, целое число.
Молекулярность реакции- число молекул, участвующих в элементарном химическом акте.
В простых реакциях порядок и молекулярность может совпадать.
Факторы влияющие на скорость реакции
Температура влияет на скорость и описываеться уравнением Вант- Гоффа
 =
= 
∆t=T2-T1
Скорость реакции пропорциональны произведению концентрации реагирующих веществ, взятых в степенях равных стехиометрическим коэфициентам
ɑA+ɓB+...+ɨI→
V=k* 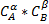 *…..*
*…..* 
k- константа скорости химической реакции
Закон действующих масс
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
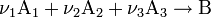
Правило Вант- Гофа
Голландский ученый Ван-Гофф показал, что при увеличении температуры на десять градусов скорость большинства реакций увеличивается в 2 - 4 раза.
Температура влияет на скорость и описываеться уравнением Вант- Гоффа
 =
= 
∆t=T2-T1
Уравнение Арениуса
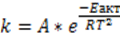
Еакт- энергия активации, которая определяется природой реагирующих веществ
А- предэкспонинцеальный множитель
Физический смысл:
Для протекания химических взаимодействий частиц реагирующих веществ должны войти в контакт, то есть столкнуться. Не все столкновения являются результативными. Арениус выяснил, что результативными или эффективными являются только столкновения между частицами обладающими некоторым избытком внутреней энергии по сравнению со средней для данной температуры велечиной. Этот избыток Арениус назвал энергией активации. Арениус создал теорию активных соударений. По этой теории А соответсвует общему числу столкновений двух частиц за единицу времени.
|
|
|
Правая часть уравнения Арениуса- число результативных столкновений, приводящих к образованию продукта реакции. Теория хорошо описывает реакцию в газовых фазах.
Энергия Активации
Для протекания химических взаимодействий частиц реагирующих веществ должны войти в контакт, то есть столкнуться. Не все столкновения являются результативными
Арениус выяснил, что результативными или эффективными являются только столкновения между частицами обладающими некоторым избытком внутреней энергии по сравнению со средней для данной температуры велечиной. Этот избыток Арениус назвал энергией активации.
Физический смысл, методы определения.
Физический смысл:
Для протекания химических взаимодействий частиц реагирующих веществ должны войти в контакт, то есть столкнуться. Не все столкновения являются результативными. Арениус выяснил, что результативными или эффективными являются только столкновения между частицами обладающими некоторым избытком внутреней энергии по сравнению со средней для данной температуры велечиной. Этот избыток Арениус назвал энергией активации. Арениус создал теорию активных соударений. По этой теории А соответсвует общему числу столкновений двух частиц за единицу времени.
Правая часть уравнения Арениуса- число результативных столкновений, приводящих к образованию продукта реакции. Теория хорошо описывает реакцию в газовых фазах.
Для расчёта энергии активации проводят эксперементальное определение константы скорости реакции при нескольких температурах.
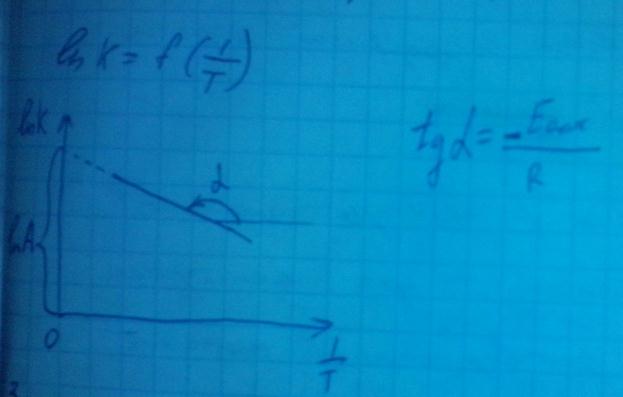
Запишем уравнение Арениуса для одной и той же реакции протекающей при двух различных температурах., так как реакция одна и та же, то природа реагирующих веществ не меняются и константы уравнения Арениуса тоже будет одинаковой.

Кинетические уравнения 1 и 2 порядка. Время полупревращиния.
|
|
|
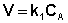 (II.6)
(II.6)
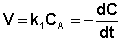 (II.7)
(II.7)
После интегрирования выражения (II.7) получаем:
 (II.8)
(II.8)
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
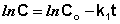 (II.9)
(II.9)
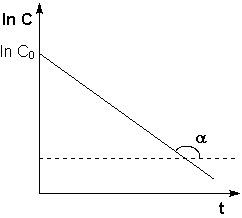
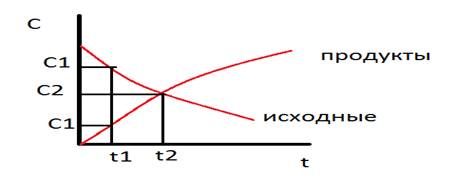
Рис. 2.3 Зависимость логарифма концентрации от времени для реакций
первого порядка
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
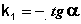 (II.10)
(II.10)
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
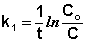 (II.11)
(II.11)
Еще одной кинетической характеристикой реакции является период полупревращения t1/2– время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
 (II.12)
(II.12)
Отсюда
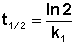 (II.13)
(II.13)
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
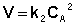 (II.14)
(II.14)
либо
 (II.15)
(II.15)
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
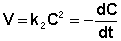 (II.16)
(II.16)
После разделения переменных и интегрирования получаем:
 (II.17)
(II.17)
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
 (II.18)
(II.18)
Т.о., для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
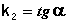 (II.19)
(II.19)
 (II.20)
(II.20)

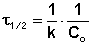
Период полупревращения
Метод определения порядка реакции
Графический метод заключается в построении графика зависимости концентрации реагента от времени в различных координатах.
Аналитический метод заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков.
|
|
|
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций.
При статистическом расбросе значений полученных вокруг некоторой средней величины, считается что мы подобрали верный порядок.
Гетерогенные процессы: кинетическая и диффузионная области процесса.
Гетерогенными называется реакции протекающие на границе раздела фаз.
Гетерогенный процесс можно разделить на пять стадий:
1) транспорт (диффузия) реагирующих веществ к поверхности катализатора;
2) адсорбция реагирующих веществ на поверхности катализатора;
3) реакция на поверхности катализатора;
4) десорбция продуктов реакции с освобождением поверхности катализатора;
5) транспорт (диффузия) продуктов реакции в объёме.
Скорость диффузии кинетически подчиняется уравнению первого порядка относительно концентрации раствора в объёме (Сх). Таким образом, если лимитирующей стадией является диффузия, то кинетика реакции определяется данным уравнением. В таком случае говорят, что процесс протекает в диффузионной области.
Если скорость химической реакции значительно меньше, чем скорость диффузии, процесс проходит в кинетической области и описывается уравнением той реакции, которая протекает на поверхности.
Катализ
процесс интенсивного изменения скорости химической реакции при помощи веществ,которые участвуют в реакции, но количество и качество которого не меняется к моменту образования продукта реакции.В присутствие конденсатора изменяет путь по которому протекает реакция.
Механизм катализаторов
Катализ химический бывает гомогенный и гетерогенный.
гетерогенный
в процессе химической реакции с участием гетерогенного катализатора, на поверхности катализатора образуются некие переходные соединения - снижающие энергию активации процесса в целом.
Гомогенный катализ - по сути - отличается тем, что переходные соединения образуются не на поверхности катализатора, а в объёме раствора. Только разновидностей гомогенных катализаторов существует великое множество.
Ингибирование - процесс торможения химической реакции.
Цепные реакции
Цепная реакция-это самоподдерживающаяся химическая реакция, при которой первоначально появляющиеся продукты принимают участие в образовании новых продуктов. Цепные реакции протекают обычно с большой скоростью и нередко имеют характер взрыва.
Стадия инициирования. На этой стадии происходит образование интермедиатов (промежуточных продуктов)
Стадия развития. На этой стадии промежуточные продукты реагируют с исходными реагентами, образуя новые интермедиаты и конечные продукты.
Стадия обрыва цепи. На этой стадии происходит окончательное расходование промежуточных продуктов или их разрушение
Цепные реакции играют важную роль во многих отраслях химии, в частности в фотохимии, химии горения
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 559; Нарушение авторских прав?; Мы поможем в написании вашей работы!