
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы
|
|
|
|
Растворы - гомогенные,термодинамические системы состоящие из 2-х или более компонентов.
-Свойства р-ров неэлектролитов.
1)Силы межмолекулярного взаимодействия отдельных компонентов одинаковы
2)Нет хим.взаимодействия между компонентами
3)Каждый компонент ведет себя независимо от других
4)Образование идеального раствора сопровождается нулевым тепловым эффектом
5)Св-во идеального р-ра при данных условиях зависит только от его концетрации.Из реальных ра-ров этим признаком наиболее полно соответствуют разбавленные растворы нелетучих неэлектролитов.
-Первый закон Рауля.
Относительное понижение давления насыщенного пара растворителя над раствором нелетучего неэлектролита равно мольной доле растворенного вещества.
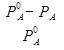 =
= 
 - давление пара чистого растворителя
- давление пара чистого растворителя
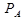 -давление пара над раствором
-давление пара над раствором
-Второй закон Рауля.
 =
=  -
- 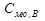 -для процесса кипения
-для процесса кипения
Депрессия прямопропорциональна моляльной концентрации растворенного в-ва.
 - [ моль/кг растворителя]
- [ моль/кг растворителя]
 - эбулио, метрическая const.
- эбулио, метрическая const.
Связана только со св-вами растворителя!!
 =
= 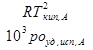
 - численно равно депрессии кипения одномоляльного р-ра.
- численно равно депрессии кипения одномоляльного р-ра.
. tкр= 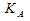
 - для процесса кристаллизации
- для процесса кристаллизации
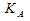 - криометрическая const
- криометрическая const
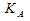 - характеризует только свойства растворителя и связана с его tкр и теплотой плавления следующим соотношением.
- характеризует только свойства растворителя и связана с его tкр и теплотой плавления следующим соотношением.
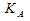 =
= 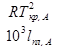 Она численно равна депрессии кристаллизации одномоляльного р-ра.
Она численно равна депрессии кристаллизации одномоляльного р-ра.
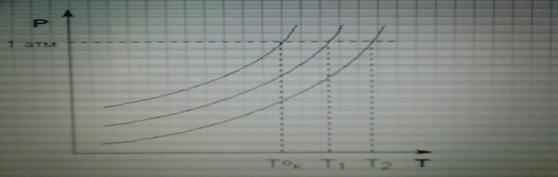
-Температура кипения.
Прямым следствием понижения давления насыщ.пара растворителя над раствором является повышенное Ткип раствора и пониженная Ткрист по с сравнению с растворителем.
Разность между Ткип раствора и чистого растворителя называется депрессией кипения.
/ tкип=tкип,р-ра---tкип,А >0
-Температура замерзания.
|
|
|
Депрессия кристаллизации равна
/ tкр=tкр,А----tкр,р-ра>0

-Растворы электролитов.Электролитическая диссоциация,степень и константа диссоциации.
Электролиты – вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда.
- Электролитическая диссоциация- процесс распада молекул электролита на ионы независимо от действия эл.тока.
-Степенью диссоциации - электролита называется отношение числа его молекул, распавшихся на ионы, к общему числу молекул электролита в растворе.

-Константа диссоциации для процесса диссоциации называется константой диссоциации (K). В общем случае для электролита,диссоциирующего на два иона:
АВ  А+ + В–
А+ + В–
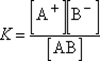
Для приведенного выше процесса диссоциации уксусной кислоты:
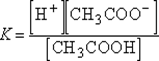
-Закон разведения Оствальда.

Если степень диссоциации слабого электролита не выше 3%,то 1-альфа=1
Альфа= 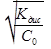 =
=  С=1/V
С=1/V
Степень диссоциации слабого электролита возрастает с разведением раствора.
Кдис вычисляемая по закону Оствальда зависит от концетрации. Увеличение n электролита вызывает увеличение числа ионов в р-ре и увеличения интенсивности(дальше пропустил парут слов в лекции).
Отклонение n количественно учитывают с помощью к.э.ф активности(гамма).Она показывает во сколько раз активность р-ра отличается от n.
Активность р-ра или эффективная n учитывает количество ионов непринимающих в данный момент участия в межинном взаимодействии
 =
= 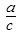
-Диссоциация воды.
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы):
|
|
|
H2O ↔ H+ + OH
υ1 = κ1 • [H2O] (для диссоциации воды)
υ2 = κ2 • [H+] • [HO-] (для обратного процесса)
где υ - скорость реакции; κ - константа скорости реакции (зависящая от природы реагирующих веществ и температуры); [H2O], [H+] и [HO-] - концентрации (моль/л).
В состоянии равновесия υ1 = υ2, следовательно:
κ1 • [H2O] = κ2 • [H+] • [HO-]
Проведем нехитрые математические действия и получим:
κ1/κ2 = [H+] • [HO-]/[H2O]
κ1/κ2 = K
-Ионное произведение воды.
Вода — слабый электролит, который незначительно диссоциирует на ионы Н+ и ОН-:
Константа диссоциации воды:
Kдис= [H+][OH-]/[H2O]
Концентрацию воды [Н2О] можно считать величиной постоянной и равной
[Н2O]=(1000 г/л)/(18г/моль) =5,56 моль/л и
[Н2О]•Kдис=55,56•1,8•  =
= 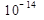
Величина Kw=Kдис•[Н2О]= 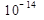 называется ионным произведением воды и является константой как для чистой воды, так и для разбавленных растворов. Ионное произведение воды увеличивается при повышении температуры.
называется ионным произведением воды и является константой как для чистой воды, так и для разбавленных растворов. Ионное произведение воды увеличивается при повышении температуры.
-Водородный показатель.
Концентрация ионов водорода и гидроксид-ионов важна в химии растворов, поэтому была введена специальная величина — водородный показатель, или pH. По определению, водородный показатель есть обратный логарифм концентрации ионов H+:
pH=-lg[H+]
pH=7 - среда нейтральная
рН<7 - среда кислая
рН>7 - среда щелочная
Для определения среды растворов используются приборы, называемые pH-метрами. Быстрый анализ можно провести, если в исследуемый раствор добавить одну-две капли кислотно-основного индикатора, т.е. такого вещества, которое под действием ионов Н+ и ОН- может резко изменять свою окраску. Изменения окрасок наиболее распространенных индикаторов приведены ниже.(это смотрите сами, если надо оставьте, если нет то нет).
-Гидролиз солей на примерах.
Гидролиз солей-это взаимодействие соли и воды имеющая характер ионного обмена которая приводит к образованию мало диссоциирующих соединений.
1)Соль образована сильной кислотой и слабым основанием.
Cu 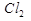 +
+ 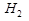 O
O  HCl+CuOHCl
HCl+CuOHCl
Cu 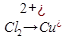 +2
+2 
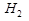 O
O 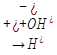
Cu+2Cl+  O
O 
Cu+  O
O  CuOH+H pH<7
CuOH+H pH<7
1)При гидролизе соли образованные сильной кислотой и слабым основанием в среде накапливаются свободные ионы Н и она становится кислой рН<7.
3)Соль образована слабым основанием и слабой кислотой.
( Cu+
Cu+ 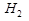 O
O  тут я не записал в лекциях.
тут я не записал в лекциях.
|
|
|
При гидролизе такой соли реакция среды будет определяться тем,что сильнее:слабая кис-та или слаб.основание. Если слаб.кис-та будет сильнее,чем слаб.основание,то гидролиз будет происходить по (1) примеру.Если же сильнее слаб.основание,чем слаб.кис-та,то гидролиз будет протекать по (2) примеру и среда будет щелочной.
Сила слаб.кис-ты и слаб.основания определяется по Кдис:Чем больше Кдис,тем сильнее кислота или основание.
4)Сильное основание и сильная кислота
LiCl 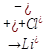 (H+Cl)
(H+Cl)
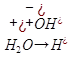 (Li+OH)
(Li+OH)

Соль образованная сильным основанием и сильной кис-той шидролизу не подвергается т.к не образует с водой мало диссоциирующих соединений.Среда при этом остается нейстральной.
Важно:
Самопроизвольно гидролиз протекает только по первой ступени,т.е с участием одной молекулы воды на один катион от слабого основания или один анион от слабой кислоты.
-Растворимость.
РАСТВОРИМОСТЬ, способность в-ва образовывать с др. в-вом (или в-вами) гомог. смеси с дисперсным распределением компонентов
Самый распространенный жидкий растворитель – вода, для нее температура растворения ограничивается интервалом 0-100 оС. Большинство растворяющихся в воде веществ являются твердыми, а по типу – солями и гидроксидами.
-Произведение растворимости.
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 472; Нарушение авторских прав?; Мы поможем в написании вашей работы!