
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эквиваленты простых и сложных веществ. Закон эквивалентов
|
|
|
|
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалентной массой называется масса 1 эквивалента вещества.
Пример 1. Определить эквивалент и эквивалентную массу элементов в соединениях НВr, Н2О и NН3.
Решение. В указанных соединениях с одним молем атомов водорода соединяется 1 моль атомов брома, 1/2 моля атомов кислорода и 1/3 моля атомов азота. Следовательно, согласно определению, эквиваленты брома, кислорода и азота равны соответственно 1 молю, 1/2 и 1/3 моля. Исходя из атомных масс этих элементов, находим, что эквивалентная масса брома равна 79,9 г/моль, кислорода - 16:2=8 г/моль, азота - 14:3 =4,67 г/моль.
Для определения эквивалента (эквивалентной массы) элемента необязательно исходить из его соединения с водородом. Эквивалент (эквивалентную массу) можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен.
Пример 2. При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найти эквивалентную массу железа и его эквивалент, если известно, что эквивалентная масса серы равна 16 г/моль.
Решение. Из условия задачи следует, что в сульфиде железа на 5,6 г железа приходится 8,8-5,6=3,2 г серы. Согласно закону эквивалентов, массы взаимо-действующих веществ прямо пропорциональны их эквивалентным массам:
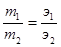
Следовательно,
5,6 г железа эквивалентны 3,2 г серы
Э г/моль» 16 г/моль серы
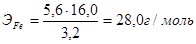
Молярная масса атомов железа численно совпадает с его относительной атомной массой и составляет 56 г/моль.
Поскольку эквивалентная масса железа (28 г/моль) в два раза меньше молярной массы его атомов, то в 1 моле железа содержится 2 эквивалента. Следовательно, эквивалент железа равен 1/2 моля.
|
|
|
На основе законов эквивалентов можно вывести следующие формулы для вычисления эквивалентных масс сложных веществ – оксидов, кислот, оснований и солей:

где М – молярная масса соединений, г / моль; Э – их эквивалентная масса.
Пример 3. Вычислить эквиваленты Н2SO4 и Аl(ОН)3 в реакциях, выражаемых уравнениями
Н2SO4 + КОН = КНSO4 + Н2O; (1)
Н2SO4 + Mg = MgSO4 + Н2; (2)
Al(OH)3 + HCl = Al(OH)2Cl + H2O; (3)
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O. (4)
Решение. Эквивалент сложного вещества, как и эквивалент элемента, может иметь различные значения и зависит от того, в какую реакцию вступает это вещество.
Так, эквивалент серной кислоты в реакции (1) равен 1 моль, а эквивалентная масса  ; в реакции (2) – эквивалент равен ½ моль, эквивалентная масса, следовательно,
; в реакции (2) – эквивалент равен ½ моль, эквивалентная масса, следовательно,  . Аналогично рассчитывается эквивалент гидроксида алюминия: в реакции (4)
. Аналогично рассчитывается эквивалент гидроксида алюминия: в реакции (4) 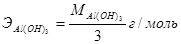 , а в реакции (3)
, а в реакции (3) 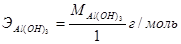 .
.
Эквивалентным объемом называется объем, занимаемый при данных условиях одним эквивалентом газообразного вещества.
Так, 1 моль водорода Н2 занимает объем 22,4 л при нормальных условиях. Поскольку эквивалент водорода равен 1 моль атомов, то в 22,4 л Н2 содержится 2 эквивалента, поэтому эквивалентный объем водорода равен 22,4/2 = 11,2 л/моль.
Пример 4. Некоторое количество металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Решение. Зная, что эквивалентный объем водорода равен 11,2 л/моль, составляем пропорцию на основании закона эквивалентов:
28 г металла эквивалентны 11,2 л водорода
Х г металла «-» 0,7 л водорода
* Основность кислоты определяется числом атомов водорода, которые замещаются на металл. Кислотность основания определяется числом гидроксильных групп, замещающихся на кислотный остаток.
1. Рассчитайте эквивалентную массу металла, зная, что его сульфид содержит 52% металла, а эквивалентная масса серы равна 16 г/моль.
|
|
|
2. Один грамм некоторого металла реагирует с 1,78 г серы или 8,89 г брома. Вычислите эквивалентные массы брома и металла, если известно, что эквивалентная масса серы составляет 16 г/моль.
3. Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,173 г одного из галогенов. Определите эквивалент галогена.
4. При разложении 0,4638 г оксида металла получено 0,4316 г металла. Определите эквивалентную массу металла.
5. Сколько литров водорода (условия нормальные) потребуется для восстановления 112 г оксида металла, содержащего 71,43% металла? Каковы эк-вивалентная масса и эквивалент металла?
6. 1 г двухвалентного металла вытесняет из кислоты при нормальных условиях 0,921 мл водорода. Определите, с каким металлом вступает в реакцию кислота.
7. Известно, что 0,432 г металла образуют 0,574 г хлорида. Вычислите экви-валентную массу металла, приняв эквивалентную массу хлора равной 35,5 г/моль.
8. При восстановлении водородом 10,17 г оксида двухвалентного металла образовалось 2,25 г воды, эквивалентная масса которой 9,00 г/моль. Вычислите эквивалентные массы металла и его оксида.
9. Вычислите эквивалентную массу ортофосфорной кислоты в реакциях с раствором КОН с образованием: а) дигидрофосфата калия; б) гидрофосфата калия; в) фосфата калия.
10. Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определите массу металла.
11. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
12. Один оксид марганца содержит 22,56% кислорода, а другой - 50,50%. Вычислите эквивалентные массы марганца в этих оксидах и составьте их форму-лы.
13. Вещество содержит 39,0% серы, эквивалентная масса которой 16,0, и мышьяк. Вычислите эквивалентную массу и валентность мышьяка. Составьте формулу этого вещества.
14. На нейтрализацию 0,943 г фосфористой кислоты НзРОз израсходовано 1,291 г КОН. Вычислите эквивалентную массу кислоты и ее основность.
15. Во всех ли реакциях эквивалентная масса и эквивалент вещества имеют одно и то же значение? Чему равна эквивалентная масса серной кислоты в случае образования средней соли и в случае образования кислой соли? Ответ подтвердите уравнениями реакций и расчетами.
|
|
|
16. При сгорании серы в кислороде образовалось 12,8 г оксида серы(IV). Сколько эквивалентных масс кислорода потребуется на эту реакцию? Чему равны эквивалентные массы серы и ее оксида?
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода, измеренного при нормальных условиях. Вычислите эквивалентную массу и определите, с каким металлом реагировала кислота.
18. На нейтрализацию 1 г основания израсходовано 2,14 г соляной кислоты. Вычислите эквивалентную массу основания.
19. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную и атомную массы элемента. Составьте уравнение реакции образования этого оксида.
20. Какова взаимосвязь эквивалентных и молярных масс для гидроксида кальция, ортофосфорной кислоты, сульфата железа(III), хлорида олова(IV)? Ответ подтвердите соответствующими расчетами.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 10721; Нарушение авторских прав?; Мы поможем в написании вашей работы!