
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение эквивалентной или нормальной концентрации
|
|
|
|
Определение молярной концентрации раствора
Молярная концентрация или молярность (См или М) – число молей рас-творенного вещества, содержащихся в 1 л раствора. Предположим, что имеет-ся раствор фосфорной кислоты: 1,5М Н3РО4 или См = 1,5 моль/л Н3РО4; это означает, что в 1 л или в 1000 мл такого раствора содержится в количестве 1,5 моля Н3РО4 или 1,5×98 = 147 г, где 98 г/моль – молярная масса фосфорной кис-лоты.
Пример 3. Определите массу нитрата натрия, которая требуется для при-готовления 2 л децимолярного (0,1М) раствора.
Решение. В 1 лраствора содержится См×М = 0,1×85 = 8,5 г нитрата натрия.
Составим пропорцию: в 1 л раствора содержится 8,5 г NaNO3;
в 2 л раствора содержится х г NaNO3.
Тогда х =  =17 г NaNO3 нужно взять, чтобы приготовить 2 л 0,1М раствора.
=17 г NaNO3 нужно взять, чтобы приготовить 2 л 0,1М раствора.
В общем виде решение можно представить как
m = V ×См×М, (2)
где V – объем, л;
См – молярная концентрация, моль/л;
М – молярная масса, г/моль.
Пример 4. Определите массовую долю азотной кислоты (в процентах) в 4,3М растворе НNO3, плотность которого составляет r = 1,14 г/мл.
Решение. Определим массу кислоты, содержащейся в 1 л раствора по формуле (2):
m НNO3 = V ×См×М = 1×4,3×63 = 271 г.
Определим массу 1 литра (1000 мл) раствора азотной кислоты:
m = V ×r = 1000×1,14 = 1140 г.
Следовательно, массовая доля кислоты составит
w НNO3 = m НNO3/ m = 271/1140 = 0,238 или 23,8 %.
Эквивалентная концентрация или нормальность (Сн или Н) – число эквивалентов растворенного вещества, содержащихся в 1 л раствора (Сн = 0,75 моль/л или 0,75Н).
Пример 5. Какое количество сульфата натрия содержится в 400 мл 0,6 Н раствора?
Решение. В 1 л раствора содержится 0,6 молярных масс эквивалента сульфата натрия или См×Эм = 0,6×71 = 42.6 г.
Составим пропорцию:
в 1 л раствора содержится 42,6 г Na2SO4;
в 0.4 л раствора содержится х г Na2SO4.
Отсюда х = 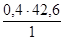 = 17,4 г Na2SO4 нужно взять, чтобы приготовить 400 мл 0,6Н раствора.
= 17,4 г Na2SO4 нужно взять, чтобы приготовить 400 мл 0,6Н раствора.
В общем виде
m = V ×Сн Эм, (3)
где Сн– нормальная концентрация, моль/л;
Эм – молярная масса эквивалента растворенного вещества, г/моль.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 411; Нарушение авторских прав?; Мы поможем в написании вашей работы!