
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции
|
|
|
|
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Степень окисления – это условный заряд атомов в молекуле, вычисленный из предположения, что молекула состоит только из ионов. Степень окисления может иметь нулевое, отрицательное и положительное значение, которое обычно указывают над символом элемента: Na2+O-2, H+N+5O3-2, K+Cl-1. Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в электронейтральном состоянии: Cl02, H02, O02, N02, Al0, Ba0. Отрицательное значение степени окисления имеют атомы, которые приняли электроны:
Cl0 + 1  ® Cl-; S0 + 2
® Cl-; S0 + 2  ® S2-.
® S2-.
Такой процесс называется восстановлением. При этом степень окисления понижается.
Положительное значение степени окисления имеют атомы, отдающие электроны:
Ba0 - 2  ® Ba2+; Р0 - 5
® Ba2+; Р0 - 5  ® Р+5.
® Р+5.
Такой процесс называется окислением. В общем случае степень окисления атома понижается на столько единиц, сколько электронов принимает данный атом:
Mn+7 + 1  ® Mn+6; Fe+3 + 3
® Mn+6; Fe+3 + 3  ® Fe0; S+6 + 2
® Fe0; S+6 + 2  ® S+4.
® S+4.
При отрыве определенного количества электронов степень окисления повышается на соответствующее число единиц:
S-2 - 6  ® S+4; Cl- - 1
® S+4; Cl- - 1  ® Cl0; Mn+2 - 2
® Cl0; Mn+2 - 2  ® Mn+4.
® Mn+4.
У одноатомных ионов степень окисления равна заряду иона: для иона K+ - +1, для иона Ba2+ - +2, для иона S2- - -2 и т.д. Пользуясь этими сведениями, можно вычислять степени окисления атомов в сложных соединениях. При этом следует помнить: алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
Пример 1. Вычислите степень окисления фосфора в молекуле Н3РО4.
Решение. Обозначив степень окисления фосфора через х –Н3+1 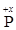 О4-2– и умножив известные нам степени окисления водорода (+1) и кислорода (-2) на число этих атомов в молекуле, составим уравнение
О4-2– и умножив известные нам степени окисления водорода (+1) и кислорода (-2) на число этих атомов в молекуле, составим уравнение
|
|
|
(+1)×3 + х + (-2)×4 = 0.
Отсюда х = +5. Таким образом, степень окисления фосфора равна +5, т.е Н3Р+5О4.
Пример 2. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
SnO + KMnO4 + HCl ® SnCl4 + MnCl2 + KCl + H2O.
Укажите окислитель и восстановитель, какое вещество окисляется, какое – восстанавливается.
Решение. 1. Определите, какие атомы в левой и правой частях уравнения меняют степени окисления, подсчитайте и надпишите величины степеней окисления над символом соответствующего атома.
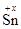 О-2; х + (-2) = 0; х = +2;
О-2; х + (-2) = 0; х = +2; 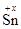 Cl-14; х + (-1)×4 = 0; х = +4;
Cl-14; х + (-1)×4 = 0; х = +4;
К+1 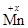 О4-2; +1 + х + (-2)×4 = 0; х = +7;
О4-2; +1 + х + (-2)×4 = 0; х = +7;
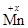 Cl2-1; х + (-1)×2 = 0; х = +2.
Cl2-1; х + (-1)×2 = 0; х = +2.
Таким образом, степени окисления изменяются у атомов Sn и Mn:
Sn+2О + KMn+7O4 + HCl ® Sn+4Cl4 + Mn+2Cl2 + KCl + H2O.
2. Составьте электронные уравнения, т.е. схемы изменения зарядов атомов в левой и правой частях:
Sn+2 - 2  = Sn+4;
= Sn+4;
Mn+7 + 5  = Mn+2.
= Mn+2.
3. Принимая во внимание, что число отданных и принятых электронов должно быть одинаковым, найдите дополнительные множители, поменяв их местами, поставьте за вертикальной чертой и укажите восстановитель и окислитель, процессы окисления и восстановления:
восстановитель Sn+2- 2  = Sn+4 = Sn+4
| 5 процесс окисления; |
окислитель Mn+7 + 5  = Mn+2 = Mn+2
| 2 процесс восстановления. |
4. Дополнительные множители 5 и 2 и будут коэффициенты, стоящие перед формулами соединений олова и марганца. Их перенесите в общее уравнение:
5Sn+2О + 2KMn+7O4 + HCl ® 5Sn+4Cl4 + 2Mn+2Cl2 + KCl + H2O.
5. Коэффициенты перед формулами веществ, атомы которых не меняют свою степень окисления, подберите в следующей последовательности: а) коли-чество атомов металлов (здесь – К); б) количество атомов неметаллов (здесь – Cl); в) количество атомов водорода; г) кислорода.
Если процесс доуравнивания проводился верно, то количество всех атомов в правой и левой частях уравнения будет одинаковым.
Выполненное задание имеет вид:
5Sn+2О + 2KMn+7O4 + 26HCl ® 5Sn+4+ 2Mn+2Cl2 + 2KCl + 13H2O.
|
|
|
восстановитель Sn+2- 2  = Sn+4 = Sn+4
| 5 процесс окисления |
окислитель Mn+7 + 5  = Mn+2 = Mn+2
| 2 процесс восстановления. |
Классификация окислительно-восстановительных реакций
Обычно различают три типа окислительно-восстановительных реакций.
1. Межмолекулярные. К ним относятся реакции, в которых окислитель и восстановитель находятся в разных веществах. Рассмотренная в примере 1 реакция относится к этому типу.
2. Внутримолекулярные. В них окислитель и восстановитель находятся в одном и том же веществе. В этом случае атом с более положительной степенью окисления окисляет атом с меньшей степенью окисления. Такими реакциями являются реакции термического разложения:
2Na  O3 = 2Na
O3 = 2Na 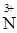 O2 + O02
O2 + O02
3. Реакции диспропорционирования. Сопровождаются одновременным по-нижением и повышением степени окисления атомов одного итого же элемента:
3Н 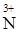 O2 = Н
O2 = Н 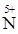 O3 + 2
O3 + 2 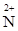 О + H2O
О + H2O
N3+ - 2  = N5+ = N5+
|  1 1
| ||
N3+ + 1  = N2+ = N2+
|
Вполне очевидно, что в реакции участвуют 3 моль НNO2; 1 моль является восстановительным, а 2 – окислительным.
221. Составьте электронные уравнения реакций, протекающих по схемам
Fe(ОН)2 + O2 + Н2О ® Fe(ОН)3;
KJ + BaCrO4 + HCl ® J2 + BaCl2 + CrCl3 + KCl + H2O.
Для каждой реакции укажите окислитель, восстановитель. Расставьте коэффици-енты в уравнениях реакций.
222. По схемам реакций определите окислительно-восстановительные реак-ции:
K2Cr2O7 + H2SO4(конц) ® CrO3 + K2SO4 + Н2О;
Pb + S ® PbS;
AsH3 +KMnO4 + H2SO4 ® H3AsO4 + K2SO4 + MnSO4 + Н2О.
Составьте для них электронные уравнения и расставьте коэффициенты в уравнениях реакций. Укажите, какое вещество является окислителем, какое – вос-становителем в каждой из окислительно-восстановительных реакций.
223. Составьте электронные уравнения и укажите, какой процесс – окисле-ние или восстановление - происходит при следующих превращениях:
S2- ® S4+; Р3- ® Р5+; Mn4+ ® Mn2+.
На основании электронных уравнений расставьте коэффициенты в урав-нении реакции, идущей по схеме
MnSO4 + PbO2 + HNO3 ® HMnO4 + Pb(NO3)2 + PbSO4 + Н2О.
224. Исходя из степени окисления серы в соединениях Н2S, H2SO3, H2SO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
|
|
|
BaFeO4 + HCl ® Cl2 + BaCl2 + FeCl3 + Н2О.
225. Укажите реакции, в которых азот проявляет: а) восстановительные свойства; б) окислительные свойства; в) не изменяет степени окисления:
K2Cr2O7 + NaNO2 + H2SO4 ® Cr2(SO4)3 + NaNO3 + K2SO4 + Н2О;
KNO2 + H2SO4 + KJ ® NO + K2SO4 + J2 + Н2О;
Mg3N2 + Н2О ® Mg(OH)2 + NH3.
Составьте для них электронные уравнения. Укажите окислитель и восстанови-тель. Расставьте коэффициенты в уравнениях реакций.
226. Какая из приведенных реакций относится к реакциям внутримолеку-лярного окисления-восстановления?
KBrO ® KBrO3 + KBr;
Pb(NO3)2 ® PbO + NO2 + O2;
Ca(HCO3)2 ® CaCO3 + CO2 + Н2О.
Расставьте коэффициенты в уравнениях реакций.
227. Найдите окислитель и восстановитель и на основании электронных уравнений подберите коэффициенты в уравнениях реакций, идущих по схемам
Cr2O3 + KOH + KClO3 ® K2CrO4 + KCl + Н2О;
MnO2 + K2CO3 + KNO3 ® K2MnO4 + KNO2 + CO2.
228. Какие реакции относятся к реакциям диспропорционирования:
AgNO3 ® Ag + NO2 + O2;
P + Н2О ® H3PO4 + PH3;
HClO3 ® HCl + HClO4.
Расставьте коэффициенты в уравнениях реакций. Укажите, какие элементы окис-ляются, какие восстанавливаются.
229. Исходя из степени окисления серы, объясните, какую роль окислителя или восстановителя играет сернистая кислота в реакциях, идущих по схемам
H2S + H2SO3 ® S + Н2О;
HClO4 + H2SO3 ® HCl + H2SO4.
Причину объясните. Подберите коэффициенты, пользуясь электронными уравне-ниями; назовите в обоих случаях окислитель и восстановитель.
230. Исходя из степени окисления марганца, серы и азота в соединениях KMnO4, H2S, NH3, объясните, какое из них проявляет только окислительные свойства; только восстановительные свойства. Почему? Составьте электронные уравнения и подберите коэффициенты в уравнении реакции, идущей по схеме
KMnO4 + НNO2 + H2SO4 ® MnSO4 + НNO3 + К2SO4 + Н2О.
Укажите окислитель и восстановитель.
231. Составьте электронные уравнения и укажите, какой процесс - окисле-ние или восстановление происходит при следующих превращениях:
Mn6+ ® Mn2+; Cl5+ ® Cl-.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Cu2O + НNO3 ® Cu(NO3)2 + NO + Н2О.
232. Составьте электронные уравнения для реакций, протекающих по схемам
|
|
|
Fe + KMnO4 + H2SO4 ® Fe2(SO4)3 + К2SO4 + MnSO4 + Н2О;
PbO2 + HCl ® PbCl2 + Cl2 + Н2О.
Расставьте коэффициенты, укажите окислитель и восстановитель.
233. Исходя из строения атомов элементов, укажите, какие из ионов могут играть роль восстановителей и почему: Ag+, Fe2+, Cl-, Al3+, S2-.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Р + НNO3 + Н2О ® H3PO4 +NO.
234. Составьте электронные уравнения процессов окисления и восстанов-ления для реакций, протекающих по схемам
Zn + НNO3 ® N2O + Zn(NO3)2 + Н2О;
FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 + KCl + Н2О.
Расставьте коэффициенты, укажите окислитель и восстановитель.
235. Реакции выражаются схемами
Р + НJO3 + Н2О ® H3PO4 +HJ;
H2S + Cl2 + Н2О ® H2SO4 + HCl.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество окисляется, какое восста-навливается.
236. Составьте электронные уравнения для реакций, протекающих по схе-мам
K2FeO4 + NH4OH ® Fe(OH)3 + N2 + KOH;
MnSO4 + Br2 + NaOH ® Na2MnO4 + NaBr + Na2SO4 + Н2О.
Для каждой реакции укажите окислитель и восстановитель. Расставьте коэффи-циенты в уравнениях реакций.
237. Укажите реакции, в которых водород проявляет: а) восстановительные свойства; б) окислительные свойства; в) не изменяет степени окисления.
Mg + H2SO4 ® MgSO4 + H2;
Na + H2 ® NaH;
BaH2 + Н2О ® Ba(OH)2 + H2;
H2SO4 + Zn ® ZnSO4 + H2S + Н2О.
Составьте электронные уравнения. Укажите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций.
238. Определите, к какому типу окислительно-восстановительных реакций относятся процессы, протекающие по схемам
H2MnO4 ® HMnO4 + MnO2 + Н2О;
HClO4 + H2SO3 ® HCl + H2SO4;
KClO3 ® O2 + KCl.
Расставьте коэффициенты в уравнениях реакций, применяя метод электронного баланса. Для каждой реакции укажите окислитель и восстановитель.
239. Какая из приведенных реакций относится к реакциям межмоле-кулярного окисления-восстановления:
NH4NO3 ® N2O + Н2О;
H2SbO3 + K2Cr2O7 + HCl ® H3SbO4 + CrCl3 + KCl + Н2О;
KClO3 ® KCl+ KClO4.
Составьте электронные уравнения. Укажите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, применяя метод электронного баланса.
240. Исходя из положения брома и иода в Периодической системе химичес-ких элементов, объясните, у какого из веществ HJ или HBr сильнее проявляются восстановительные свойства в реакциях, протекающих по схемам
HBr + H2SO4 ® Br2 + SO2 + Н2О;
HJ + H2SO4 ® J2 + H2S + Н2О.
Методом электронного баланса подберите коэффициенты и укажите окислитель и восстановитель.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 1818; Нарушение авторских прав?; Мы поможем в написании вашей работы!