
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 13. Получение оксида фосфора(V) и его свойства
|
|
|
|
Опыт 12. Окислительные свойства азотной кислоты
Опыт 11. Окислительные и восстановительные свойства азотистой кислоты
Возьмите две пробирки. В одну налейте 1 мл иодида калия, а в другую - 1 мл раствора перманганата калия. В каждую пробирку добавьте по 1-2 мл раствора H2SO4 (2н), а затем 1-2 мл насыщенного раствора (или немного сухой соли) нитрита натрия. Что наблюдаете? Напишите уравнения реакций и объясните, какие свойства проявляет нитрит натрия в каждой из реакций.
KI + H2SO4 + NaNO2 ® I2¯ + NO + Na2SO4 + K2SO4 + H2O
KMnO4 + H2SO4 + NaNO2 ® MnSO4 + NaNO3 + K2SO4 + H2O
Возьмите две пробирки. В одну пробирку поместите 1-2 кусочка меди, прибавьте 2-3 мл концентрированной азотной кислоты. Какой газ выделяется в этой реакции? Разбавьте раствор. Запишите наблюдения. В другую пробирку поместите кусочек цинка и налейте 1-2 мл концентрированной азотной кислоты. Запишите наблюдения. Разбавьте раствор. Что наблюдаете? Напишите уравнение реакции.
Cu + HNO3 (конц.) ® Cu(NO3)2 + NO2 + H2O
Cu + HNO3 (разб.) ® Cu(NO3)2 + NO + H2O
Zn + HNO3 (конц.) ® Zn(NO3)2 + N2O (NO2) + H2O
Zn + HNO3 (разб.) ® Zn(NO3)2 + N2 + H2O
В фарфоровую чашку возьмите несколько крупинок красного фосфора. Подожгите его нагретой стеклянной палочкой. Закройте горящий фосфор стеклянной воронкой и соберите образующийся оксид фосфора(V) в пробирку, надетую на конец воронки. Налейте в пробирку с оксидом фосфора(V) дистиллированной воды. Часть полученного раствора налейте в отдельную пробирку и добавьте в нее несколько капель метилоранжа. Метилоранж окрашивается в красный цвет. Какая реакция среды в пробирке? К другой части раствора оксида фосфора(V) в воде прилейте 2-3 капли раствора AgNO3. Обратите внимание на цвет осадка. Какая кислота получилась при растворении P2O5 в холодной воде? Напишите уравнение реакции.
Примечание: осадок метафосфата серебра имеет белую окраску, а осадок ортофосфата серебра - желтую окраску.
P2O5 + H2O ® 2HPO3 D2H+ + 2PO3-
HPO3 + AgNO3 ® AgPO3¯ + HNO3
HPO3 + H2O 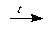 H3PO4
H3PO4
H3PO4 + 3AgNO3 ® Ag3PO4¯ + 3HNO3
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 670; Нарушение авторских прав?; Мы поможем в написании вашей работы!