
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрия
Реагенты для фотометрического определения железа (III)
ОПРЕДЕЛЕНИЕ ЖЕЛЕЗА (III)
Ионы железа (III) образуют с роданид-ионами комплексные соединения кроваво-красного цвета
Fe3+ + (3 - 6) SCN- = [Fe(SCN)3-6] 0 - (-3)
Окраска растворов неустойчива, поэтому их готовят непосредственно перед измерением оптической плотности.
Порядок выполнения работы
1. Возьмите 6 мерных колб на 100 мл для приготовления стандартных растворов соли железа (III). Напишите на них стеклографом номера 1, 2, 3, 4, 5, 6.
2. Налейте из бюретки в колбы, начиная с колбы № 1, точное число мл раствора соли железа (III), который содержит 0,02 мг железа в 1 мл раствора (см. табл. 4) или данные преподавателя.
3. В каждую колбу цилиндром добавьте по 2 мл разбавленной (1:1) азотной кислоты и по 10 мл 10%-ного раствора роданида аммония NH4SCN. Добавьте дистиллированной воды до метки, закройте пробкой, хорошо перемешайте.
Таблица 4
| № колбы | Объем соли железа (III), мл | Концентрация железа (III), мг/мл | Объем раствора HNO3, мл | Объем р-ра NH4SCN, мл | Оптич. плотность |
| 0,5 | |||||
| 1,0 | |||||
| 2,0 | |||||
| 3,0 | |||||
| 4,0 | |||||
| 5,0 | |||||
| х | х |
4. Измерьте оптическую плотность каждого стандартного раствора в кюветах с b= 34 мм с использованием синего светофильтра. За “нулевой раствор” возьмите дистиллированную воду. Результаты измерений запишите в таблицу 4.
5. По полученным значениям оптической плотности постройте калибровочный график на миллиметровой бумаге в координатах А - C.
6. Получите у преподавателя контрольную задачу с неизвестной концентрацией соли железа (III) (колба № х), добавьте 2 мл разбавленной (1:1) азотной кислоты, 10 мл раствора роданида аммония, доведите дистиллированной водой до метки. Закройте пробкой, хорошо перемешайте.
7. Измерьте оптическую плотность контрольного раствора Аx и по калибровочному графику определите концентрацию железа (III) Сх. Узнайте у преподавателя точной значение концентрации раствора и вычислите погрешность измерения.
Метод потенциометрии основан на зависимости потенциала электрода, погруженного в раствор, от концентрации определенных ионов в данном растворе (уравнение Нернста). Потенциал применяемого в работе стеклянного электрода зависит от концентрации ионов водорода в растворе, что используется при измерении рН. Стеклянный электрод в паре с электродом сравнения, потенциал которого не зависит от рН, опускают в определяемый раствор и измеряют разность их потенциалов. Вольтметр, применяемый для измерений, имеет шкалу, градуированную как в милливольтах, так и в единицах рН, что позволяет снимать показания рН раствора непосредственно со шкалы прибора.
При кислотно-основном титровании добавление каждой порции титранта вызывает изменение рН раствора. На этом основано потенциометрическое титрование. К точному объему определяемого раствора последовательно добавляют небольшие порции стандартного раствора и после каждого добавления измеряется рН. Точку эквивалентности определяют графически (см. рис.1 и 2).
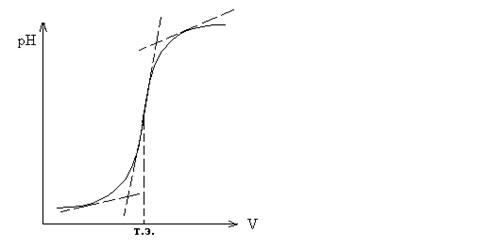
Рис. 1. Интегральная кривая: точка эквивалентности соответствует середине отрезка касательной скачка титрования
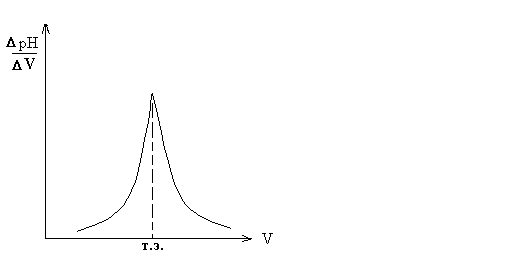
Рис. 2. Дифференциальная кривая: точка эквивалентности соответствует максимуму кривой.
Лабораторная работа № 12
|
|
Дата добавления: 2015-01-03; Просмотров: 452; Нарушение авторских прав?; Мы поможем в написании вашей работы!