
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Используя метод стационарных концентраций, определите, каков порядок этой реакции по пероксиду водорода
|
|
|
|
Отсюда
8. Рассчитайте изменение константы скорости реакции, имеющей энергию
активации 191 кДж/моль, при увеличении температуры от 330 до 400 К.
Решение. Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса
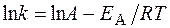
или
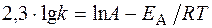
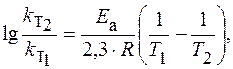 |
Логарифм отношения констант скоростей реакции при температурах Т 2 и Т 1 соответственно равен
где R = 8,31 Дж/(моль×К) – универсальняая газовая постоянная.
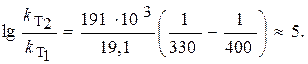
Подставив в это уравнение данные задачи, получим

Следовательно,
9. Реакция разложения пероксида водорода
2Н2О2 ® 2Н2О + О2
в кислой среде и в присутствии ионов брома в качестве катализатора
протекает по следующему механизму:
k1
Н2О2 + Вr- + Н+ ® НВrО + Н2О (1)
k2
Н2О2 + НВrО ® Н2О + Вr- + Н+ + О2 (2).
Решение. Согласно методу стационарных концентраций
 |
 |
 |
Скорость реакции по пероксиду водорода может быть выражена следующим образом:
После подстановки с НВrО в полученное уравнение имеем:
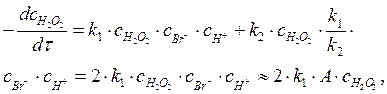 |
где А = const, т. к. концентрация ионов брома, как катализатора не должна существенно изменяться, как и концентрация ионов водорода в кислой среде.
Таким образом, порядок этой реакции по пероксиду водорода равен единице (показатель степени при концентрации Н2О2 в кинетическом уравнении).
10. При исследовании кинетики реакции распада диметилового эфира были
получены следующие данные:
| Время, с (t) | ¥ | ||||
| Повышение давления, Па (D р ×10-4) | 1,28 | 2,35 | 3,33 | 6,23 | 8,25 |
Начальное давление диметилового эфира 4,16×104 Па. Рассчитайте порядок реакции и константу скорости распада диметилового эфира.
|
|
|
Решение. Предположим, что реакция имеет первый порядок:

Вместо концентраций используем давления, тогда получим
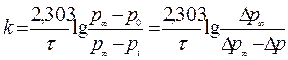 |
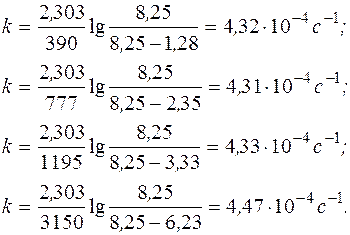 |
Подставляя соответствующие значения изменения давления со временем в полученное уравнение, рассчитаем константу скорости:
Константа скорости постоянна в пределах погрешности эксперимента, следовательно, предположение, что реакция является реакцией I-го порядка, верно.
Отсюда k ср = 4,36×10-4 с-1.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 1412; Нарушение авторских прав?; Мы поможем в написании вашей работы!