
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адиабатический процесс. Политропный процесс
|
|
|
|
Адиабатическим называется процесс, при котором отсутствует теплообмен (dQ=0) между системой и окружающей средой. К адиабатическим процессам можно от-
нести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
Из первого начала термодинамики (dQ=dU+dA) для адиабатического процесса следует, что
dA=-dU, (55.1)
т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя выражения (52.1) и (53.4), для произвольной массы газа перепишем уравнение (55.1) в виде
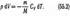
Продифференцировав уравнение состояния для идеального газа pV=(m/M)RT, получим

Исключим из (55.2) и (55.3) температуру Т:
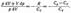
Разделив переменные и учитывая, что Ср/Сv =g (см. (53.8)), найдем
dp/p=-gdV/V.
Интегрируя это уравнение в пределах от р 1 до р 2 и соответственно от V 1 до V 2, а затем потенцируя, придем к выражению
p 2 /p l=(V1/V2)g.
или
p 1vg1 = p 2vg2.
Так как состояния 1 и 2 выбраны произвольно, то можно записать
рVg= const. (55.4)
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
Для перехода к переменным Т, V или р, Т исключим из (55.4) с помощью уравнения Клапейрона — Менделеева
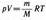
соответственно давление или объем:
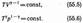
Выражения (55.4) — (55.6) представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина (см. (53.8) и (53.2))

называется показателем адиабаты (или коэффициентом Пуассона). Для одноатомных газов (Ne, He и др.), достаточно хорошо удовлетворяющих условию идеальности, i = 3, g=1,67. Для двухатомных газов (Н2, N2, O2 и др.) i= 5, g=1,4. Значения g, вычисленные по формуле (55.7), хорошо подтверждаются экспериментом.
|
|
|
Диаграмма адиабатического процесса (адиабата) в координатах р, V изображается гиперболой (рис.83). На рисунке видно, что адиабата (pVg=const) более крута, чем изотерма (pV =const). Это объясняется тем, что при адиабатическом сжатии 1 — 3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.

Вычислим работу, совершаемую газом в адиабатическом процессе. Запишем уравнение (55.2) в виде

Если газ адиабатически расширяется от объема V 1 до V 2, то его температура уменьшается от T 1 до T 2 и работа расширения идеального газа

Применяя те же приемы, что и при выводе формулы (55.5), выражение (55.8) для работы при адиабатическом расширении можно преобразовать к виду

Работа, совершаемая газом при адиабатическом расширении 1 — 2 (определяется площадью, выполненной в цвете на рис. 83), меньше, чем при изотермическом. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом — температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность — они происходят при постоянной теплоемкости. В первых двух процессах теплоемкости соответственно равны Cv и С р, в изотермическом процессе (d T= 0) теплоемкость равна ±¥, в адиабатическом (dQ=0) теплоемкость равна нулю. Процесс, в котором теплоемкость остается постоянной, называется политропным.
Исходя из первого начала термодинамики при условии постоянства теплоемкости (C = const) можно вывести уравнение политропы:
|
|
|
pVn = const, (55.9) где n= (C- Ср)/(С-Cv) — показатель политропы. Очевидно, что при С = 0, n=g из (55.9) получается уравнение адиабаты; при С=¥, n =1 —уравнение изотермы; при С=СР, n = 0 — уравнение изобары, при С = Сv, n =±¥ —уравнение изохоры. Таким образом, все рассмотренные процессы являются частными случаями политропного процесса.
§56. Круговой процесс (цикл). Обратимые и необратимые процессы
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой (рис.84). Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1 — 2) и сжатия (2 — 1) газа. Работа расширения (определяется площадью фигуры 1 a2V 2 V 1 1) положительна (dV>0), работа сжатия (определяется площадью фигуры 2b1V 1 V 2 2) отрицательна (dV<0), Следовательно, работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. Если за цикл совершается положительная работа  (цикл протекает по часовой стрелке), то он называется прямым (рис. 84, а), если за цикл совершается отрицательная работа
(цикл протекает по часовой стрелке), то он называется прямым (рис. 84, а), если за цикл совершается отрицательная работа  (цикл протекает против часовой стрелки), то он называется обратным (рис. 84,б).
(цикл протекает против часовой стрелки), то он называется обратным (рис. 84,б).
Прямой цикл используется в тепловых двигателях — периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл

используется в холодильных машинах — периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю. Поэтому первое начало термодинамики (51.1) для кругового процесса
Q=DU+A=A, (56.1)
т. е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Однако в результате кругового процесса система может теплоту как получать, так и отдавать, поэтому
Q=Q1-Q2,
где Q1— количество теплоты, полученное системой, q 2 — количество теплоты, отданное системой. Поэтому термический коэффициент полезного действия для кругового процесса

Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
|
|
|
Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что ее любое промежуточное состояние есть состояние термодинамического равновесия; для него «безразлично», идет процесс в прямом или обратном направлении. Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т.д.), которая нами не обсуждается. Обратимые процессы — это идеализация реальных процессов. Их рассмотрение важно по двум при-чинам: 1) многие процессы в природе и технике практически обратимы; 2) обратимые процессы являются наиболее экономичными; имеют максимальный термический коэффициент полезного действия, что позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
§ 57. Энтропия, ее статистическое толкование и связь с термодинамической вероятностью
Понятие энтропии введено в 1865г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты.
Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно d Q/T. Строгий теоретический анализ показывает, что приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю:

Из равенства нулю интеграла (57.1), взятого по замкнутому контуру, следует, что подынтегральное выражение d Q/T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. Таким образом,

Функция состояния, дифференциалом которой является d Q/T, называется энтропией и обозначается S.
|
|
|
Из формулы (57.1) следует, что для обратимых процессов изменение энтропии
DS=0. (57.3)
В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает:
DS>0. (57.4)
Выражения (57.3) и (57.4) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. Соотношения (57.3) и (57.4) можно представить в виде неравенства Клаузиуса
DS³0, (57.5)
т. е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Если система совершает равновесный переход из состояния 1 в состояние 2, то, согласно (57.2), изменение энтропии
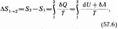
где подынтегральное выражение и пределы интегрирования надо выразить через величины, характеризующие исследуемый процесс. Формула (57.6) определяет энтропию лишь с точностью до аддитивной постоянной. Физический смысл имеет не сама энтропия, а разность энтропии.
Исходя из выражения (57.6), найдем изменение энтропии в процессах идеального газа. Так как d U=(m/M)Cv dT,

т. е. изменение энтропии DS1®2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида процесса перехода 1®2.
Так как для адиабатического процесса dQ = 0, то DS=0 и, следов
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 901; Нарушение авторских прав?; Мы поможем в написании вашей работы!