
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні теоретичні відомості
|
|
|
|
Прилади, обладнання та матеріали, що використовуються в роботі
ВИВЧЕННЯ КОНСТРУКЦІЇ ТА ПРИНЦИПУ ДІЇ ПРИЛАДУ ДЛЯ ВИМІРЮВАННЯ КОНЦЕНТРАЦІЇ ВОДНЕВИХ ІОНІВ
Лабораторна робота № 4
Контрольні запитання
Звіт з лабораторної роботи
Звіт з лабораторної роботи повинен містити:
3.5.1. Тему, мету і порядок виконання роботи.
3.5.2. Результати виконання завдань із результатами вимірювань у таблицях, результати розрахунків та опис ходу виконання роботи.
3.5.3. Оформлені висновки з лабораторної роботи.
3.6.1 Що являє собою інклінограма, які параметри необхідно вимірювати для її одержання?
3.6.2 Які прилади називають інклінометрами, як їх класифікують?
3.6.3 Опишіть структурну схему інклінометра ІТ-200, назвіть його основні характеристики.
3.6.4 Поясніть роботу електричної схеми інклінометра.
3.6.5 Опишіть порядок роботи з інклінометром для визначення кута нахилу й азимуту.
3.6.6 Як здійснюється обробка отриманих результатів вимірювання?
Мета роботи: Ознайомитись з принципом дії, конструкцією та роботою приладу для вимірювання концентрації водневих іонів на базі перетворювача П-201.
Тривалість роботи: 2 аудиторні години.
4.2.1 Перетворювач типу П-201;
4.2.2 Електроди: вимірювальний електрод типу ЕСЛ-4ІГ-04– 1 шт, допоміжний електрод – ЕВЛ-1М1 – 1 шт;
4.2.3 Міліамперметр М-І730;
4.2.4 Коаксіальний кабель типу РК - 1 шт.;
4.2.5 Буферні розчини, досліджувані розчини невідомої концентрації; лакмусовий папір.
Для зручності вираження концентрації іонів водню хімік Зеренс ввів поняття рН (р - початкова буква датського слова міра (ступінь), Н - гідроген). Відповідно до цього водневий показник рН - десятинний логарифм концентрації іонів гідрогену з від'ємним знаком: pОН = -lg[H+]; аналогічно для іонів гідроксиду; pOH=-lg[H-].
|
|
|
Для чистої води за температурою 22°С рН = 7. Для нейтрального середовища значення рН дорівнює 7, кислого - менше 7, лужного - понад 7. Для дуже кислих середовищ рН менше нуля (-1, -2) і для лужних більше 14 (15,16).
Важливим питанням є визначення рН в неводних і змішаних розчинах. Це питання має велике практичне значення, оскільки й в нафтопереробній промисловості і харчовій промисловості, при виробництві пластмас та в інших галузях промисловості широко використовують вимірювання рН у водних і неводних розчинах.
Дуже часто вимірювання pН у неводних розчинах здійснюють щодо водного каломельного електроду, потенціал якого визначають за водним стандартом. При цьому фактично вимірювання зводять до вимірювання ЕРС кола:
Pt(H2) | стандартний | досліджуваний| Pt(H2)
водний розчин неводний розчин
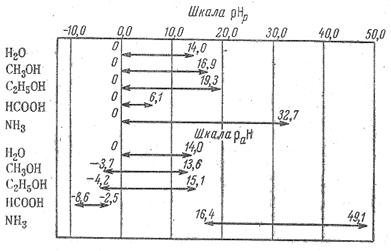
Рисунок 5.1 - Шкала рНр і шкала раН в різних розчинах
Переходячи від води до неводного розчину, переходять від кислотності, вираженій в концентраціях або активностях одного іона - іона гідроксонію, до кислотності, вираженій у концентраціях або активностях іншого іона – ліонія.
При оцінюванні рН розчинів в межах одного розчинника слід враховувати протяжність шкали рН: у воді вся шкала рН рівна 14,0, в етиловому спирті - 19,3; в мурашиній кислоті - 6,1 і т. ін. (рис.4.1)
У наш час єдиною речовиною, за допомогою якої може бути здійснено стандартизацію рН у неводних розчинах, є хлористий водень, оскільки для нього є дані про коефіцієнти активності в більшості розчинниках і в їх сумішах з водою. Як електрод порівняння при вимірюваннях у неводних розчинах може бути використаний хлористо-срібний електрод у розчині НCl, котрий придатний для вимірювання в низці чистих неводних розчинників і їх сумішах з водою.
Виміряна по відношенню до стандарту в даному розчиннику рН не є абсолютною мірою кислотності неводного розчину й може бути використана для характеристики кислотності тільки в межах даного розчинника. Це слідує з того, що початок шкали кислотності раНр =0 не відповідає рівності абсолютних активностей іонів водню у всіх розчинниках. Величини раН нейтральних розчинів у різних розчинниках не співпадають один з одним, оскільки протяжність шкал, що залежить від іонного добутку розчинника, різна. У верхній частині рис. 5.1 як приклад наведено шкали рНр у воді й деяких неводних середовищах. У воді шкала рН змінюється від 0 до 14; нейтральним розчином називають розчин з рН = 7. Якщо розчин має рН=0, це розчин кислоти з активністю іонів Н+, рівного одиниці; якщо розчин має рН = 14, це розчин луги з активністю іонів ОН--, рівного одиниці, але це не означає, що не може бути розчинів у воді з рН менше нуля і більше 14.
|
|
|
Розчин, у котрого рН =15, означає розчин луги з активністю, рівного 10, розчини з рН = -1 є розчинами кислоти з активністю, рівного 10.
Таким чином, треба мати на увазі, як відноситься величина рН даного розчину до рН нейтрального розчину.
Тому запропоновано відмічати показник рН індексом, рівним рН нейтральної точки. У воді рН слід відмічати індексом 7 - рН7, в етиловому спирті індексом 9,7 — рН9,7 і т. ін.
Для визначення хімічного складу розчинів та вимірювання їх концентрації широко застосовують електрохімічні методи, до яких відносять кондуктометричні, потенціометричні, кулонометричні та полярографічні методи. В аналізі розчинів важливими є потенціометричний метод, який встановлює зв'язок між електродним потенціалом та активною концентрацією іонів у розчині. Цей метод призначено для вибіркового вимірювання активної концентрації певних іонів. Найширше потенціометричний метод застосовують для вимірювань активної концентрації іонів водню. Потенціометричний метод вимірювання рН заснований на вимірюванні електричного потенціалу при розміщенні спеціальної електродної системи в розчин, що аналізується. ЕРС електродної системи пов'язана з активністю іонів води в розчині та температурою.
Метод побудований на вимірюванні концентрації іонів з використанням двох електродів, потенціал одного з яких відомий. Електрод з постійним потенціалом називається допоміжним, другий з змінним потенціалом – вимірювальним.
|
|
|
При сполученні зовнішнім зв’язком індикаторного (вимірювального) та допоміжного електродів (рис. 4.2) занурених в контрольований розчин, утворюється гальванічний елемент, який в подальшому називатимемо вимірювальним елементом для потенціометричних вимірювань.
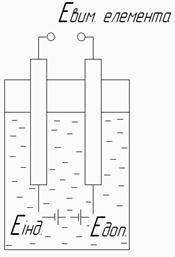
Рисунок 4.2 – Вимірювальний та допоміжний електроди
ЕРС вимірювального елемента рівна алгебраїчній сумі потенціалів індикаторного та допоміжного електродів:
 . (4.1)
. (4.1)
При сталому потенціалі допоміжного електрода ЕРС вимірювального елемента визначається як
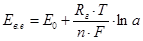 , (4.2)
, (4.2)
де 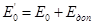 ; Т – температура, Кє; n – число молекул розчину.
; Т – температура, Кє; n – число молекул розчину.
Якщо відомий нормальний потенціал індикаторного електрода 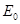 та потенціал допоміжного
та потенціал допоміжного  , то вираз (4.2) однозначно визначає величину активності іонів.
, то вираз (4.2) однозначно визначає величину активності іонів.
На відміну від потенціалу індикаторних електродів, потенціал допоміжного повинен залишатись незмінним при коливанні активності концентрації іонів у всьому діапазоні вимірювання.
Електродна система (рис. 4.4) складається з двох електродів: вимірювального, потенціал якого залежить від активності (концентрації) іонів гідрогену в розчині, і порівняльного (допоміжного), потенціал якого під час вимірювання залишається сталим і занурюється він у насичений розчин хлористого калію.

Рисунок 4.4 - Електродна система pH-метра
Найчастіше рН розчинів вимірюється електродами, виготовленими з спеціального скла з домішками одновалентних металів: літію, калію, натрію. Скляні електроди малоінерційні, мають стабільні характеристики. Корпус 2 каліброваної трубки виготовлено із спеціального скла. Мембрана 1 може мати будь-яку форму -кулі, конусу, площини. Внутрішня частина електрода заповнена нормальним розчином соляної кислоти 3 з невеликою кількістю кристалів хлористого срібла. У розчині кислоти розміщений контактний електрод 4, який через пробку 5 і гумовий ковпачок 6 кабельним наконечником 7 підключається до вимірювального приладу ВП.
|
|
|
Порівняльним електродом може бути хлористо-срібний або ж каломельний електрод. Внутрішня частина хлористо-срібного електрода заповнена насиченим розчином хлористого калію. Контактний срібний електрод 8, покритий малорозчинною сіллю хлористого срібла, заведений у розчин, а другий його кінець через пробку 5 і гумовий ковпачок 6 кабельним наконечником 7 підведений до вимірювального приладу ВП. Контакт вимірюваного розчину з розчином хлористого калію відбувається через пористу перегородку 9.
Взаємодія розчину з скляною поверхнею призводить до виникнення різниці потенціалів Ех, зумовленої активністю іонів водню в розчині:
Ex=Eo+(2,3·RT/F)lg aH, (4.3)
де Ео - нормальний потенціал; R - універсальна газова стала; Т - температура; F - число Фарадея; а - активність водневих іонів у розчині.
Таким чином, вимірюючи потенціал скляного електрода можна знайти рН розчину. Загальна ЕРС комірки дорівнює алгебраїчній сумі контактних ЕРС:
∑E = Ek+Eвк+Ex+Eд+En, (4.4)
де: Ек - контактна ЕРС між електродом і розчином соляної кислоти; Евк - контактна ЕРС внутрішньої поверхні скляного електрода; Ед - дифузійний потенціал на межі контрольованого розчину і розчину КС1; Ех - контактна ЕРС між скляним електродом і контрольованим розчином; Еп - різниця потенціалів на межі срібний електрод — розчин КСІ.
Всі названі ЕРС, крім Ех, сталі, а сумарна ЕРС вимірювальної комірки пропорційна контактній ЕРС зовнішньої мембрани скляного електрода Ех. За принципом дії рН-метри поділяються на такі основні групи приладів: безпосереднього відліку, з статичною та антистатичною компенсаціями.
Метод безпосереднього відліку використовується в лабораторних рН-метрах, точність вимірювання яких становить ± 0,05 рН. Компенсаційні схеми найчастіше використовуються в автоматичних рН-метрах з динамічною та статичною компенсаціями.
Промисловість випускає датчики заглибленого типу ДПг-4М та проточного типу ДМ-5М, із нержавіючої сталі X1810Т з скляними електродами типів ЕСП-01-14, ЕСТК-1М та порівняльними хлористо-срібними електродами; перетворювачі типу П-201, П-205, П-210,П-215 та рН-метри типів рН-201, рН-125 тощо.
У хімічній практиці також застосовується колориметричний метод, заснований на здатності деяких речовин змінювати свій колір в залежності від концентрації іонів водню в розчині. Як індикатори для такого методу використовують фенолфталеїн, лакмусовий папір та ін. Але даний метод характеризується низькою точністю оцінювання концентрації, неможливістю проводити безперервне вимірювання та передавати результати вимірювання на відстань. Тому даний метод застосовують як допоміжний чи експрес-метод.
4.3 Підготовка установки до роботи і проведення вимірювань
5.3.1 Ознайомитися з описом лабораторної роботи.
Опис лабораторної установки.
Схема лабораторної установки для вимірювання концентрації водневих іонів на базі перетворювача типу П-201 зображено на рис. 4. 5.
Перетворювач промисловий типу П-201 являє собою пристрій для вимірювання активності іонів водню (величину рН) та інших одновалентних катіонів, шляхом перетворення вимірюваної величини в уніфікований вихідний сигнал постійного струму згідно ГОСТ 9895-69 і працює як підсилювач постійного струму, з глибоким зворотнім зв’язком за вихідним струмом, чим і забезпечує високий вхідний опір.
У комплекті з чутливим елементом перетворювач використовують для вимірювання рН технологічних розчинів у системах безперервного контролю і автоматичного регулювання технологічних процесів.
Перетворювач типу П-201 живиться від мережі 220В, 50Гц. На виході перетворювач з’єднаний з міліамперметром 2 (рис. 4.5), шкала якого проградуйована в межах від 0 до 10 рН.
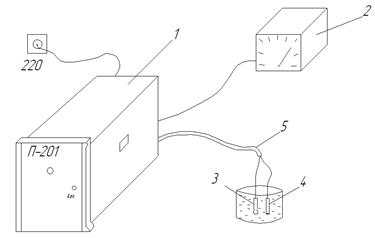
Рисунок 4.5 – Загальна схема установки для вимірювання концентрації водневих іонів на базі перетворювача типу П-201
Пара електродів (вимірювальний 3 та допоміжний 4) з’єднані з перетворювачем за допомогою коаксільного кабеля типу РК.
Відлік вимірюваної величини здійснюється за шкалою вимірювального приладу відградуйованого в одиницях рН. Відлік можна проводити також за вторинними приладами, (градуйованих в одиницях рН) підключеними до перетворювача.
Для підключення вторинних записуючих і регулюючих струмових приладів перетворювач має струмовий вихід з границею вимірювання 0-5 мА (див. рис. 4. 6).
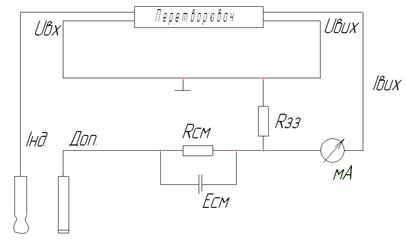
Рисунок 4.6 - Схема підключення П-201
4.3.2 Зібрати схему згідно з рис. 4.7.
4.3.3 Ввімкнути прилад і прогріти його протягом 10-15хв.
4.3.4 Налаштувати прилад з буферних розчинів таким чином: опустити електроди в буферний розчин «рН=4» (керуючись написом на банці) і спостерігати за показами мілівольтметра, встановлюючи стрілку на поділці 4 шляхом обертання маховика резистора R2 - «S20» (рис. 4.8).. Після цього опустити електроди в буферний розчин «рН = 9» і встановити стрілку на відмітці 9, повертаючи маховик резистора R6 - «нач. грубо».

Рисунок 4.7– Схема включення приладу П- 201
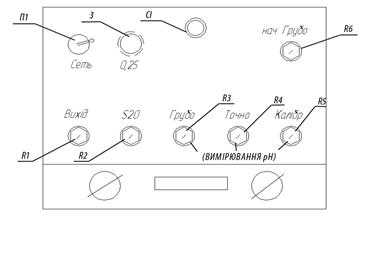
Рисунок 4.8 – Передня панель перетворювача П-201: П1 – вимикач; З – запобіжник; СІ – світлова індикація; R1 – R6 – органи керування перетворювачем для проведення настроювання та вимірювання.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 970; Нарушение авторских прав?; Мы поможем в написании вашей работы!