
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Краткая теория. Приборы и принадлежности
|
|
|
|
Приборы и принадлежности
Работа 66. Изучение спектра атома водорода
Контрольные вопросы.
1. Фотоэффект и его виды.
2. Уравнение Эйнштейна для фотоэффекта.
3. Вольтамперная характеристика фотоэффекта.
4. Законы Столетова для фотоэффекта.
5. Что такое задерживающее напряжение.
6. Какова цель данной лабораторной работы?
7. Какие производят измерения и какие строят графики?
8. Как определить постоянную Планка?
Цель работы
Исследование видимой части спектра атома водорода и определение постоянной Ридберга.
Монохроматор – спектрометр, ртутная лампа, водородная трубка, конденсор, источник высокого напряжения с пусковым устройством.
Энергии электронов в атомах могут принимать только определенные дискретные значения. Состояния, отвечающие этим значениям энергии, называются энергетическими уровнями. При переходе электронов на более низкие энергетические уровни излучаются спектральные линии. Совокупность линий, отвечающих переходам на один и тот же нижний уровень, образует спектральную серию.
Наиболее простой является система энергетических уровней атома водорода. Квантовая теория даёт для значений энергии водородного атома формулу:
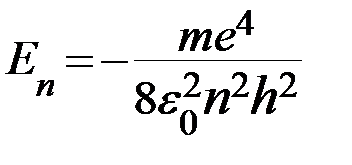 . (n=1,2,3,…) (1)
. (n=1,2,3,…) (1)
где n – главное квантовое число,
m – масса электрона,
e – заряд электрона,
ε 0 - электрическая постоянная,
h – постоянная Планка.
Энергия электрона отрицательна, т.к. он находится в атоме в связанном состоянии.
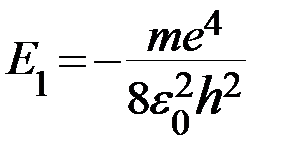 = − 13,55 эВ;
= − 13,55 эВ;
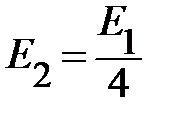 = − 3,39 эВ;
= − 3,39 эВ;
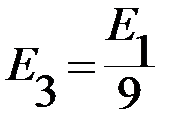 = − 1,5 эВ,
= − 1,5 эВ,
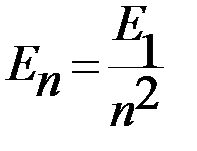 .
.
Определим частоту излучения кванта энергии атомом.
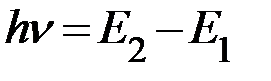 ;
; 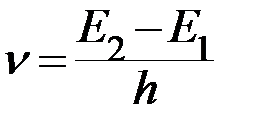 ;
;
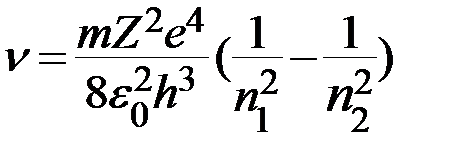 . (2)
. (2)
Обозначим постоянную Ридберга для водорода
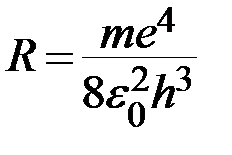 . (3)
. (3)
после вычислений получим значение 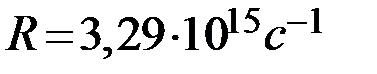 .
.
Для частоты после введения постоянной можно записать формулу
|
|
|
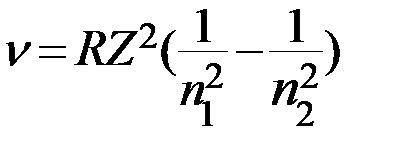 .
.
Для атома водорода заряд 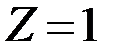 .
.
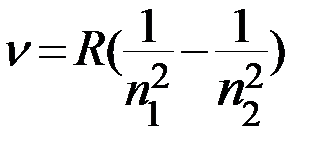
Учитывая связь частоты и длины волны 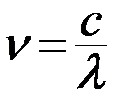 , получаем обобщенную формулу Бальмера для длины волны
, получаем обобщенную формулу Бальмера для длины волны
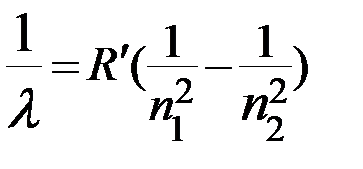 , (4)
, (4)
где 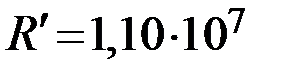 м-1 также называется постоянной Ридберга,
м-1 также называется постоянной Ридберга, 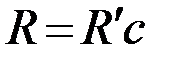 ,
,
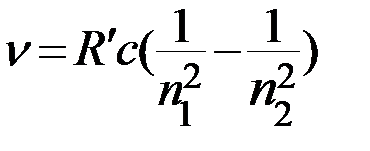
Эта формула явилась обобщением формулы, найденной опытным путём швейцарским физиком И. Бальмером в 1885 году для известных тогда линий спектра водорода.
В 1913 году датский физик Н. Бор, сделав некоторые допущения, содержащиеся в двух высказанных им постулатах, сумел дать теоретическое объяснение спектральным закономерностям, наблюдаемым для атома водорода и дал вывод формулы Бальмера.
Для атома водорода теория Бора даёт те же возможные значения энергии, что и квантовая механика. Однако попытки, используя те же допущения, построить теорию атома гелия потерпели неудачу.
Совокупность линий, определяемая формулой Бальмера при n =1 и m=2,3,4,… образует серию, обнаруженную в 1906 году Т. Лайманом. Эта серия лежит в ультрафиолетовой области спектра (серия Лаймана) Первая из инфракрасных серий (n=3, m=4,5,6,…) была обнаружена в 1908 году Ф. Пашеном и носит его имя. Следующая только в 1922году Ф. Брекетом (n=4, m=5,6,7,…).
Серия Бальмера лежит в видимой и близкой ультрафиолетовой области спектра (примерно от 360 нм до 660нм).
Возможные переходы в водородном атоме можно представить наглядно с помощью схемы энергетических уровней, представленной на Рис 1
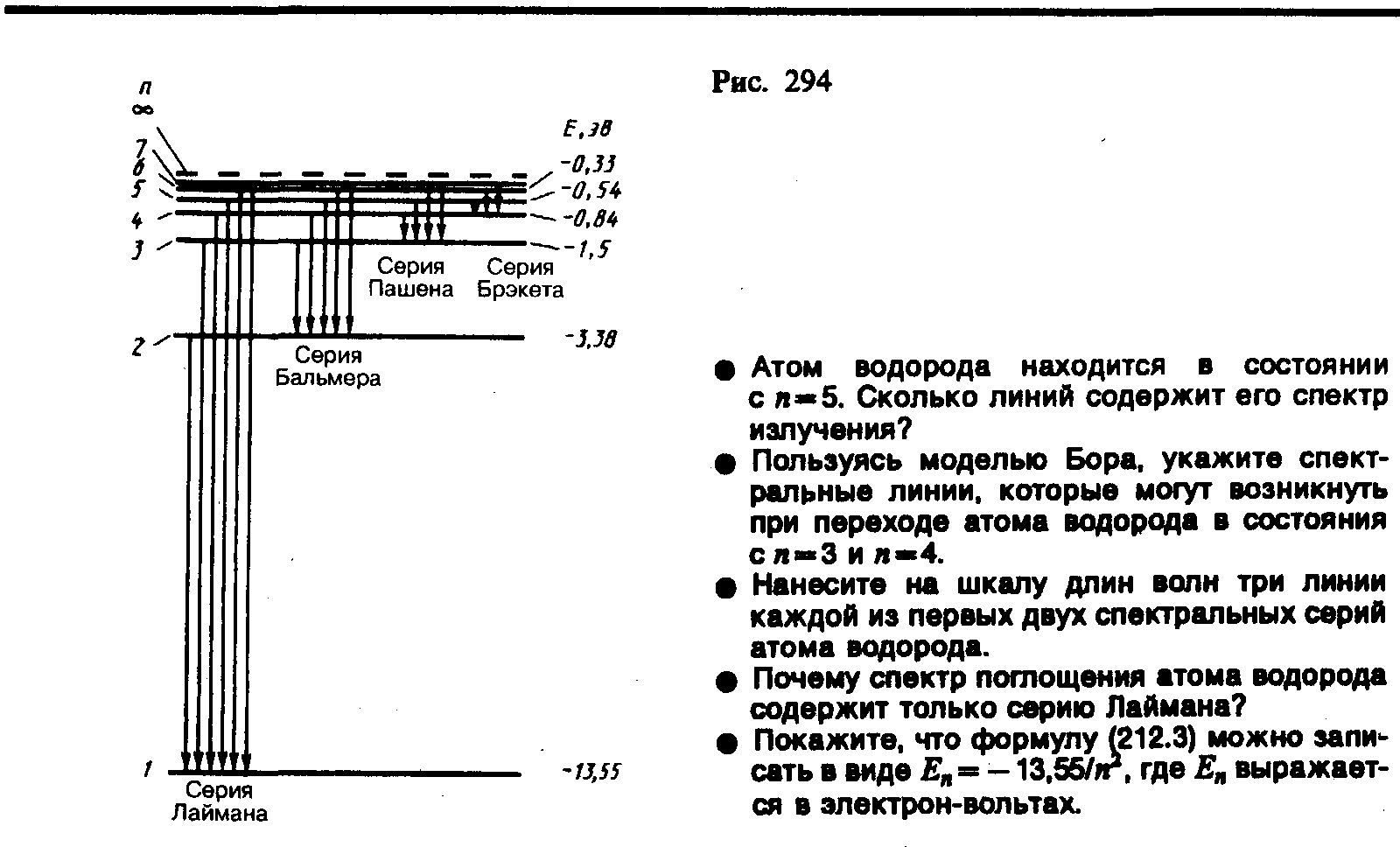
| Рис. 1 |
Из рисунка видно, что линии в спектре водорода можно расположить по сериям. Для всех линий одной и той же серии значение n остаётся постоянным,а m может принимать любые целые значения, начиная с n +1.
Состояние атома с минимальной энергией Е1 называется основным. Если атом получит извне некоторое количество энергии, то, в зависимости от её величины, он может перейти в одно из возбужденных состояний. При этом электрон оказывается на одном из уровней с номерами 2,3,4,…. Такое состояние системы является неустойчивым. Через время порядка 10-8 с электрон из возбужденного состояния переходит на уровень с меньшим значением энергии. Избыток энергии будет испущен в виде светового кванта. В конечном счете, атом возвращается в основное состояние. Поскольку одновременно излучает огромное количество атомов, в спектре излучения наблюдаются все возможные в данных условиях линии, хотя в каждом из атомов в данный момент совершается лишь один какой – либо из возможных переходов.
|
|
|
При получении энергии извне электрон может не только перейти на лежащий выше уровень, но и оторваться от атома. Минимальное количество энергии, которое требуется, чтобы оторвать электрон от атома, находящегося в основном состоянии, называется энергией ионизации атома или энергией связи электрона в атоме.
Иногда используют понятие потенциала ионизации. Под потенциалом ионизации называется разность потенциалов, которую должен пройти электрон в электрическом поле, чтобы приобрести энергию, равную энергии ионизации атома.
Энергии, соответствующие всем уровням атома (кроме уровня n = ∞) имеют отрицательные значения. Связано это с тем что за нуль потенциала поля ядра был выбран потенциал в бесконечно удаленной от него точке и в качестве нуля энергии выбрали энергию электрона, расположенного вдалеке от протона. Когда электрон ближе его энергия меньше, т.е. меньше нуля Энергия наименьшая при n =1 и возрастает к нулю с ростом n.
В данной работе изучается серия Бальмера.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 479; Нарушение авторских прав?; Мы поможем в написании вашей работы!