
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическое введение. Оборудование: установка Клемана-Дезорма
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ВОЗДУХА МЕТОДОМ АДИАБАТИЧЕСКОГО СЖАТИЯ И РАСШИРЕНИЯ
Оборудование: установка Клемана-Дезорма.
Внутренняя энергия одного моля идеального газа может быть выражена уравнением:
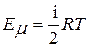 , (1)
, (1)
где: R - универсальная газовая постоянная, T - абсолютная температура,  i - число степеней свободы.
i - число степеней свободы.
Числом степеней свободы твердого тела называют число независимых координат, с помощью которых можно полностью описать его положение в пространстве. В общем случае молекула газа, рассматриваемая в виде жестко связанных атомов, может перемещаться в пространстве совершенно произвольно, т.е. участвовать в шести одновременных независимых движениях (рисунок 1) трех вращательных вокруг трех взаимно перпендикулярных осей ά, β, γ, проходящих через центр тяжести молекулы, и трех поступательных движений вдоль трех осей прямоугольной системы координат x, y, z. Таким образом в общем случае молекула газа может иметь шесть степеней свободы: три поступательных и три вращательных. Однако молекулы содержат различное число атомов, что и отражается на общем числе степеней свободы.


 Частица одноатомного газа рас- z γ β
Частица одноатомного газа рас- z γ β
сматривается в виде материальной
 точки. Поступательное движение та- α
точки. Поступательное движение та- α
кой точки определяется тремя коор-
динатами,  а при ее вращении она не x
а при ее вращении она не x
изменяет своего положения в прост- y Рисунок 1
ранстве. Следовательно, частица одноатомного газа имеет три поступательные степени свободы.
Двухатомную молекулу можно представить в виде двух жестко связанных между собой атомов (рисунок 3а). Такая молекула будет иметь три поступательные степени свободы и две вращательные вокруг двух осей β, γ перпендикулярных к линии связи между атомами. При вращении вокруг оси α совпадающей с линией связи, двухатомная молекула не меняет своего положения в пространстве. Таким образом двухатомная молекула имеет пять степеней свободы: три поступательных и две вращательных.
В трехатомной молекуле все атомы жестко связаны между собой (рисунок 3б). Такая молекула будет иметь шесть степеней свободы: три поступательных и три вращательных. Такое же число степеней свободы будет иметь и все молекулы с числом атомов больше трех. После этого отступления возвратимся вновь к рассматриваемому вопросу о внутренней энергии газа.
Приращение внутренней энергии газа ΔЕ при изменении его температуры на ∆Т в соответствии с равенством (1) примет вид:
 . (2)
. (2)
Если идеальный газ нагревается при постоянном объеме, то вся подведенная теплота затрачивается на увеличение его внутренней энергии.
Отношение приращения внутренней энергии ΔЕµ к изменению температуры ΔТ, вызвавшему это приращение энергии, называют мольной теплоемкостью:
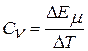 .
.
Вставляя в это равенство значение ΔЕµ из (2), получим:
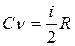 . (3)
. (3)
Если идеальный газ нагревается при постоянном давлении, то в этом случае затрачивается дополнительное количество тепла, идущее на совершение работы при расширении газа. Следовательно мольная теплоемкость газа при постоянном давлении Сp будет больше его теплоемкости Сv на величину внешней работы А, т.е. Cp = Cv + A.
Величина А = Р ΔV = Р (Vμ' - Vμ), где: Р - давление, Vμ'- мольный обьм газа после нагревания на один градус, Vμ- мольный обьем газа при температуре Т, т.е. при Т+1 = Т'.
По уравнению Клапейрона-Менделеева значения РVμ и РVμ' для температур Т и Т' выразится так
РVμ = RT и РVμ'=R(T + 1).
Вставляя эти значения в выражение работы А, а затем в уравнение теплоемкости Ср получим
Ср= Сν + R. (4)
Выражение (4) называется уравнением Майера.
Отношение теплоемкостей γ=Ср/ Сν в соответствии с равенствами (3) и (4) примет вид
 . (5)
. (5)
Полученное соотношение теплоемкостей (5) в дальнейшем будет применено для сопоставления с результатами экспериментального измерения.
|
|
Дата добавления: 2014-12-25; Просмотров: 309; Нарушение авторских прав?; Мы поможем в написании вашей работы!