
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Трилон Б
|
|
|
|
Комплексоны широко применяются в теплоэнергетике. Наиболее распространены этилендиаминтетрауксусная кислота (ЭДТА)
НООС Н2С ■ СН, СООН
N - СН, - СН, - N
НООС Н2С СН2 СООН
и ее соли. Из солей наибольшее применение в теплоэнергетике нашла двузамещенная соль ЭДГА - трилон Б. Зарубежные фирмы ЭДГА и ее солям дают различные наименования: секверстрен, комплексон -П, титриплекс-П, версен, вертан, секверстол, селектрон Б и т.д.
Соединения, образуемые комплексонами, получили наименование "клешневидных" или "хелатосоединений". Диссоциация этих соединений идет в первую очередь по внешней сфере, затем по внутренней. Комплексы, образуемые ЭДТА и ее солями, очень устойчивы. Растворимость ЭДТА невелика, значительно выше растворимость ее солей, что видно из табл. 2.3 [32].
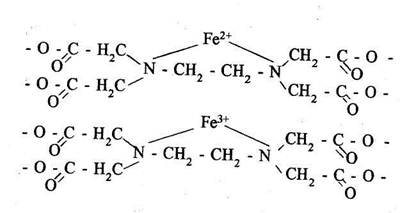
Для других катионов имеются аналогичные комплексные соединения. Так медь, латунь уже при температурах до 1001 энергично связываются в комплексы с ЭДТА и ее солями.
Термическая диссоциация ЭДТА начинается при температуре 140, а ее солей - при 16О°С. Степень диссоциации солей несколько меньше, чем ЭДТА, и в пределах концентрации до 1000 мг/л не зависит от концентрации раствора.
Для полной термической диссоциации ЭДТА и ее солей достаточно образования аминов и другея продуктов термолиза; в газовую фазу переходят СО2, Н,, СО, СН4, CHfl [20]
Соединения, образующиеся при термолизе комплексонов, обладают более высокой комплексообразующей способностью, чем исходные соединения, и с ростом температуры процесс комплексообразования ускоряется. Образующиеся комплексонаты железа при температурах выше 250 "С термически более устойчивы, чем комплексоны, но и они при 290 XZ и выше подвергаются практически полному термическому разложению. Термически наиболее устойчивыми являются комплексонаты кальция и магния, до температуры 370 tH они практически не разлагаются.
Термолиз комплексонатов железа при температуре выше 290°С протекает с образованием магнетита, который в условиях контакта с поверхностью металла образует на ней плотную защитную пленку.
В продуктах разложения комплексонатов обнаружены водород, метан и оксид углерода, максимальная концентрация которых наблюдается в свежем или вторичном паре. В турбинном конденсате эти газы не обнаруживаются, так как они отсасываются эжектором из парового пространства конденсатора. Рост концентрации водорода и оксида углерода прямо пропорционален дозе комплексона.
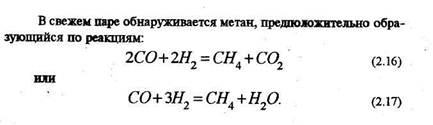
2.3. Аммиак
При комнатной температуре аммиак представляет собой бесцветный газ с удушливым резким запахом. Основные физико-химические константы аммиака приведены ниже:
Плотность при нормальных условиях, г/л 0,77
Температура плавления °С............... 77,75
Температура кипения °С.................. 33,35
Критическая температура °С............. 132,4
Аммиак хорошо растворим в воде. Один объем воды растворяет при комнатной температуре около 700 объемов аммиака. При атмосферном давлении и температуре - 33,5 Х^ аммиак переходит в прозрачную жидкость, затвердевающую при температуре - 77,8 "С. Плотность концентрированного раствора аммиака (25% - ного NH3) равна 0,91 г/см3. Раствор аммиака в воде обладает щелочной реакцией. Для многих соединений, содержащий азот, аммиак является хорошим растворителем. При обычной температуре аммиак устойчив. При непосредственном соединении его с кислотами получаются соли, например нитрат аммония, сульфат аммония и т.д. В обычных условиях аммиак довольно устойчив к действию окислителей.
С солями многих переходных металлов аммиак образует комплексные соединения. Например, аммиакат сульфата меди Си [11]
CuSO4+NH3 = [Cu(NH3\]SO4 (2.i8)
Внутренняя и внешняя сфера комплексного соединения сильно различаются по устойчивости; частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе. Лиганды, находящиеся во внутренней сфере, связаны с центральным атомом значительно прочнее и отщепляются лишь в небольшой степени:
[Си(Ж3)2]С1=*[Си(Щ)2]++С1-; (2.19)
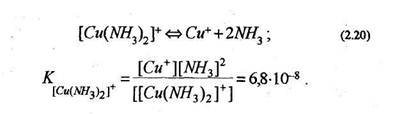
В системе вода-аммиак всегда сосуществуют три различные формы аммиака: свободная (негидратированная) NH3, молекулярная (гидратированная) NH3 • Н2О и ионная NH^ ■ Раствор аммиака является слабым электролитом с повышением температуры его основные свойства еще более ослабевают.
В процессе распределения аммиака между водой и паром в пар переходят практически только молекулярные формы:
Keud3-(Sm3+SNHyH2o\/(Sm3H2o+SNH3+Sm+y
где Kgud 3 - видимый коэффициент распределения аммиака, являющийся функцией температуры и рН, поскольку относительные доли каждой из форм аммиака зависят от этих параметров.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 2010; Нарушение авторских прав?; Мы поможем в написании вашей работы!