
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Абсолютне значення ентропії
|
|
|
|
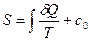 (2.34)
(2.34)
визначається з точністю до сталої інтегрування со. Різниця ентропії системи у двох довільних станах а і b, заданих, наприклад, значеннями Т і V, дорівнює:
 (2.35)
(2.35)
(інтегральне визначення ентропії).
Для оборотнього адіабатного процесу (δQ = 0) функція стану S залишається сталою Sb = Sa, то такий процес називається ізоентропним.
5. Ентропія збільшується при переході речовини у стан з більшою енергією:
S пари (ґ) > S (P) > S (T) ; (2.36)
наприклад, для води при стандартних умовах t=25°С; р°=0,101325 МПа; n°=1 моль:
 (т) = 39,3
(т) = 39,3  ;
;  (р) = 70,0
(р) = 70,0  ;
;  (ґ) = 188,7
(ґ) = 188,7  ;
;
ΔS(перегону)>ΔS(пароутворення)>>ΔS(топлення)>ΔS(поліморфного перетворення) (2.37)
Чим вища твердість речовини, тим менша його ентропія:
S(графіт) > S(алмаз) (2.38)
Карбіди, бориди і інші тверді речовини характеризуються малою ентропією. Зростання ступеня дисперсності системи також приводить до деякого збільшення її ентропії.
Ентропія аморфного тіла більше кристалічного:
S(аморф.) > S(крист.) (2.39)
Ентропія зростає по мірі ускладнення молекули речовини:
S (N2O5) > S (N2O3) > S (N2O); (2.40)
наприклад, при стандартних умовах для (ґ):
 (СО) = 197,4
(СО) = 197,4  ;
;  (СО2) = 213,0
(СО2) = 213,0  .
.
При однаковій молекулярній масі ентропія розгалужених вуглеводнів менша за нерозгалужених, наприклад, ентропія циклоалкену менша за ентропію алкену:
S(алкен) > S(циклоалкен) (2.41)
Ентропія простих речовин і сполук (наприклад, хлоридів АСln), а також її зміна при топленні і пароутворенні є періодичною функцією порядкового номера відповідного елементу.
У сукупности речовин – аналогів, наприклад АСl4 (ґаз), де А ≡ С, Si, Ge, Sn, Pb), ентропія змінюється закономірно.
Спорідненість речовин (N2 та CO; CdCl2 та ZnCl2; Ag2Se та Ag2Te; BaCO3 та BaSiO3; PbWO4 та PbMoO4) виявляється у близькости їх ентропій.
|
|
|
Закономірности зміни ентропії в рядах подібних речовин, обумовлені різницями їх будови і складу. Чим менше упорядкована речовина, тим більше її ентропія. Ентропія системи зростає зі збільшенням температури.
6. Для необоротніх процесів
ΔS =  , (2.42)
, (2.42)
тому ентропія адіабатно ізольованої системи може лише зростати:
ΔS > 0.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 1219; Нарушение авторских прав?; Мы поможем в написании вашей работы!