
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рівняння другого начала термодинаміки
|
|
|
|
1. Запишемо (6.2) dS=  в інтеґральній формі для кінцевого процесу:
в інтеґральній формі для кінцевого процесу:
ΔS=S2–S1=  (6.4)
(6.4)
2. З першої форми запису першого начала термодинаміки
δQ=dU+pdV (6.5)
та (6.2) δQ=ТdS для нерівновагового («нерівність») і рівновагового («рівність») процесів запишемо:
ТdS ≥ dU+pdV (6.6)
Розділивши (6.6) на інтеґруючий множник Т, отримаємо:
dS ≥  +
+  (6.7)
(6.7)
Для ідеального ґазу:
pV=RT, (6.8)
звідки 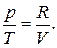 (6.9)
(6.9)
Підставивши (6.9) у (6.7), враховуючи, що
dU=CvdT, (6.10)
отримаємо
dS≥  (6.11)
(6.11)
Проінтеґруємо (6.11) для кінцевого процесу
 (6.12)
(6.12)
отримаємо (при CV=const, R=const) вираз для зміни ентропії в термодинамічному процесі:
ΔS=S2–S1≥CVln  +Rln
+Rln 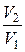 . (6.13)
. (6.13)
І далі введемо в ліву частину рівняння (6.13) 1=lne:
ΔS lne ≥ ln 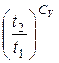 + ln
+ ln 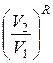 , (6.14)
, (6.14)
lneΔS ≥ ln 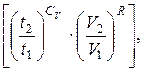 (6.15)
(6.15)
звідки
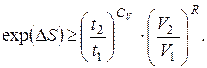 (6.16)
(6.16)
· Або при p=const з (6.8) будемо мати:
pdV=RdT. (6.17)
Підставимо (6.10) і (6.17) у (6.7):
dS≥  (6.18)
(6.18)
Проінтеґруємо (6.18) для кінцевого процесу, враховуючи, що CV=const, R=const, отримаємо зміну ентропії в термодинамічному процесі(p=const):
ΔS≥ CVln  + Rln
+ Rln 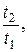 (6.19)
(6.19)
ΔS≥(CV+R)ln  . (6.20)
. (6.20)
За рівнянням Майєра для ідеального ґазу
CV + R = Cр, (6.21)
тоді
ΔS≥ Cр ln 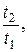 (6.22)
(6.22)
і далі
ΔS lne ≥ ln  , (6.23)
, (6.23)
lneΔS ≥ ln  ,
,
звідки для p=const
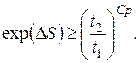 (6.24)
(6.24)
3. З другої форми запису першого начала термодинаміки
δQ = dН – Vdp (6.25)
та (6.2) δQ = ТdS запишемо:
ТdS ≥ dН – Vdp. (6.26)
Розділивши (6.26) на інтеґруючий множник Т, отримаємо:
dS≥  –
–  (6.27)
(6.27)
Для ідеального ґазу підставимо (6.8) у вигляді:
 (6.28)
(6.28)
у рівняння (6.27), враховуючи, що
dН= CрdТ, (6.29)
отримаємо
dS≥ 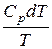 –
–  (6.30)
(6.30)
Проінтеґруємо (6.30) для кінцевого процесу
 (6.31)
(6.31)
отримаємо (при Cр=const, R=const) вираз для зміни ентропії в термодинамічному процесі:
ΔS=S2 – S1≥Cрln  –Rln
–Rln  (6.32)
(6.32)
І далі введемо в ліву частину рівняння (6.32) 1=lne:
ΔS lne ≥ ln  + ln
+ ln  (6.33)
(6.33)
lneΔS ≥ ln  (6.34)
(6.34)
звідки
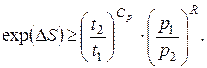 (6.35)
(6.35)
· Або при V=const з (6.8) будемо мати
|
|
|
Vdр=RdТ. (6.36)
Підставимо (6.29) і (6.36) у (6.27):
dS≥ 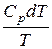 –
–  (6.37)
(6.37)
Проінтеґруємо (6.37) для кінцевого процесу, враховуючи, що Cр=const, R=const, отримаємо зміну ентропії в термодинамічному процесі:
ΔS≥  –R
–R  (6.38)
(6.38)
ΔS≥(Ср – R) 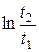 . (6.39)
. (6.39)
За рівнянням Майєра
Ср – R =CV, (6.40)
тоді
ΔS≥ CV 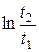 , (6.41)
, (6.41)
і далі
ΔS lne ≥ ln  (6.42)
(6.42)
lneΔS ≥ ln  (6.43)
(6.43)
звідки
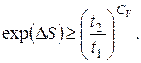 (6.44)
(6.44)
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 335; Нарушение авторских прав?; Мы поможем в написании вашей работы!