
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Залежність характеристичних функцій та ентропії від тиску. Фуґітивність
Лекція 8
РІВНЯННЯ ҐІББСА-ГЕЛЬМГОЛЬЦА
Вирази (7.53), (7.54), (7.55), (7.59), (7.60), (7.61) отримали назву рівнянь Ґіббса-Гельмгольца.
Залежність характеристичних функцій та ентропії від тиску. Фуґітивність. Підхід Льюїса. Стандартний стан. Поправка на зменшення об’єму реального ґазу. Хемічний потенціал та умови рівноваги при р,Т=const. Хемічний потенціал та умови рівноваги при V,T=const. Хемічний потенціал та умови рівноваги при V,S=const. Хемічний потенціал та умови рівноваги при p,S=const. Хемічний потенціал ідеального ґазу. Хемічний потенціал реального ґазу.
1. Термодинамічні властивости реальних ґазів розглядають на основі введення додаткових термодинамічних величин:
· фуґітивности;
· активности.
2. Рівняння для термодинамічних потенціалів і розрахунку властивостей реальних ґазів можна отримати двома способами:
2.1. На основі рівнянь термодинамічного стану реальних ґазів, наприклад
· ван-дер-Ваальса (van-der-Waals)
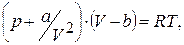 (8.1)
(8.1)
де a, b обчислюють для певного ґазу за його критичними характеристиками;
· Бітті-Бріджмена
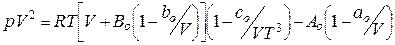 , (8.2)
, (8.2)
де ao, bo, co, Ao, Bo – характерні емпіричні сталі, які залежать від природи ґазу.
Відомо більше, ніж 150 рівнянь термодинамічного стану реальних ґазів.
Але кількісно ці рівняння часто на відповідають експериментальним даним, правдиві лише для певного значення тиску і температури, правдиві у вузькому інтервалі тисків і температур, крім того сталі, що входять у ці рівняння, навіть для звичайних умов на ~50% відрізняються від значень, розрахованих за допомогою критичних параметрів. При дуже високих тисках помилки у розрахунках термодинамічних параметрів за цими рівняннями досягають 500-600%. Використання більш складних рівнянь не може забезпечити достатню точність розрахункових показників термодинамічних властивостей реальних ґазів.
2.2. На основі підходу Льюїса (1901 р.), за яким для розрахунку показників властивостей реальних ґазів використовуються термодинамічні співвідношення, які виведені для ідеальних ґазів, і в які введено фуґітивність і активність замість абсолютного тиску і концентрації відповідно.
3. Фуґітивність f (від лат. fugitivus – втікач, леткий; леткість, звітрюваність, випаровуваність, розсіяння) даного ґазу (або і-го компоненту ґазової суміші) – це така функція абсолютного тиску р і абсолютної температури Т (і концентрації кожного з компонентів суміші), підстановка якої замість абсолютного тиску в термодинамічні рівняння для ідеального ґазу перетворює їх у правдиві рівняння для реального ґазу.
Фуґітивність f ґазу (або парціальна фуґітивність fі і-го компоненту ґазової суміші) – це величина, яка пов’язана з термодинамічними властивостями так само, як абсолютний тиск пов’язаний з цими ж величинами ідеального ґазу (парціального тиску і-го компоненту ґазової суміші):
· для ґазу f=Ψ(p,T);
· для компоненту ґазової суміші fі=Ψ(pі,T, концентрації і-го компоненту).
4. Незважаючи на те, що підхід Льюїса є формально-математичним, він при певних умовах є дієвим і точним для розрахунку показників властивостей реальних ґазів.
5. Так при T=const для ідеального ґазу (або суміші ідеальних ґазів) відомі співвідношення:
· для ідеального ґазу
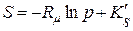 ; (8.3)
; (8.3)
 ; (8.4)
; (8.4)
 ; (8.5)
; (8.5)
 ; (8.6)
; (8.6)
 (8.7)
(8.7)
де S, G – ентропія та ізобарно-ізотермний потенціал одного моля ідеального ґазу відповідно;
∆S, ∆G – зміна ентропії та ізобарно-ізотермного потенціалу одного моля ідеального ґазу відповідно при зміні тиску;
 , KG – сума членів, які при T=const зберігають сталі значення для певного ґазу і його кількости, які чисельно дорівнюють
, KG – сума членів, які при T=const зберігають сталі значення для певного ґазу і його кількости, які чисельно дорівнюють 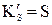 , KG=G для 1 моля, р=1 атм при даній температурі T=const.
, KG=G для 1 моля, р=1 атм при даній температурі T=const.
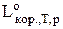 - корисна робота в оборотньому процесі.
- корисна робота в оборотньому процесі.
· для і-го компоненту суміші ідеальних ґазів
 ; (8.8)
; (8.8)
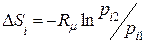 ; (8.9)
; (8.9)
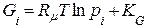 ; (8.10)
; (8.10)
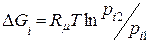 ; (8.11)
; (8.11)
 (8.12)
(8.12)
де pi – парціальний тиск і-го компоненту у суміші ідеальних ґазів;
Si – ентропія і-го компоненту у суміші ідеальних ґазів;
Gi – парціальний ізобарно-ізотермний потенціал.
6. При T=const при підстановці фуґітивности f (fі) замість тиску р (рі) у рівняння (8.3)-(8.12) отримаємо для реального ґазу (або суміші реальних ґазів) такі співвідношення:
· для реального ґазу
 ; (8.13)
; (8.13)
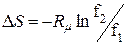 ; (8.14)
; (8.14)
 ; (8.15)
; (8.15)
 ; (8.16)
; (8.16)
 (8.17)
(8.17)
· для і-го компоненту суміші реальних ґазів
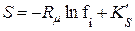 ; (8.18)
; (8.18)
 ; (8.19)
; (8.19)
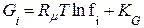 ; (8.20)
; (8.20)
 ; (8.21)
; (8.21)
 (8.22)
(8.22)
|
|
Дата добавления: 2014-12-25; Просмотров: 476; Нарушение авторских прав?; Мы поможем в написании вашей работы!