
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вплив тиску на рівновагу хемічної реакції. Принцип зміщення рівноваги Ле шательє-брауна
|
|
|
|
1. Враховуючи, що
 ; (9.94)
; (9.94)
 , (9.95)
, (9.95)
для реакції в ідеальній ґазовій суміші запишемо:
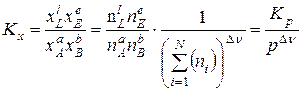 , (9.96)
, (9.96)
де  – сумарна кількість молей компонентів, що беруть участь в хемічній реакції.
– сумарна кількість молей компонентів, що беруть участь в хемічній реакції.
З (9.96) витікає, що К х (на відміну від Кр) залежить від загального тиску:
· якщо реакція відбувається із збільшенням кількостей компонентів ∆ν>0, то із збільшенням тиску К х зменшується, що означає зсув рівноваги у зворотньому напрямку;
· якщо реакція відбувається із зменшенням кількостей компонентів ∆ν<0, то із збільшенням тиску К х збільшується і зсув рівноваги відбувається зліва направо (у прямому напрямку);
· якщо реакція відбувається при ∆ν=0, то зміна тиску не впливає на рівновагу;
· якщо при ∆ν>0 до суміші компонентів за рахунок збільшення об’єму додати «інертний» ґаз (тобто той, що не бере участи в хемічній реакції) при незмінному загальному тиску, то загальна кількість молей речовин в суміші зростає ( >0). Так як р=const, то К х =const, але в (9.96) зросте чисельник
>0). Так як р=const, то К х =const, але в (9.96) зросте чисельник  і зменшиться знаменник
і зменшиться знаменник 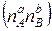 , тобто відбудеться зсув рівноваги хемічної реакції у прямому напрямку:
, тобто відбудеться зсув рівноваги хемічної реакції у прямому напрямку:
· при ∆ν<0 додавання «інертного» ґазу приведе до зсуву рівноваги у зворотньому напрямку;
· збільшення числа молей «інертного» ґазу не вплине на рівновагу.
Вплив додавання «інертного» ґазу на зсув рівноваги хемічної реакції пояснюється тим, що при цьому (при р=const) зростає об’єм реакційної суміші, що аналогічно зменшенню тиску при відсутности «інертного» ґазу.
2. Для реакції в реальній ґазовій суміші замість (9.96) будемо мати (враховуючи, що  ):
):
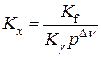 , (9.97)
, (9.97)
де ∆ν – зміна стехіометричних коефіцієнтів.
При зміні тиску Кγ змінюється, так як залежить від коефіцієнтів фуґітивности реаґентів, а Кf=const. Так як при цьому Кγ змінюється у меншій мірі, ніж р∆ν, тому у реальній ґазовій суміші якісно залишаються ті ж висновки про напрямок зсуву рівноваги при ∆ν>0, ∆ν<0, ∆ν=0, які були зроблені для хемічної реакції в ідеальній ґазовій суміші.
|
|
|
3. Вплив тиску на рівновагу в ідеальному розчині незначний, так як об’єм розчину з-за малої стисливости рідин майже не змінюється від тиску.
4. Якщо розчинник не бере участи в хемічній реакції, то розведення розчину (додавання розчинника) можна розглядати як збільшення кількости «інертної рідини» в реакційній суміші згідно (9.96).
5. Рівняння (9.96) є вислідом 1го і 2го начал термодинаміки. З нього можна кількісно визначити вплив тиску або «інертного ґазу» (або «інертної рідини») на вміст реаґентів у рівноваговій суміші ідеальних або неідеальних ґазів та ідеальних або неідеальних розчинах.
6. Для якісного визначення напрямку зсуву рівноваги в хемічній реакції користуються принципом зміщення рівноваги Ле Шательє-Брауна:
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 554; Нарушение авторских прав?; Мы поможем в написании вашей работы!