
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение. 2 страница
|
|
|
|
 |
V 

 образование зародышей
образование зародышей
 рост кристаллов
рост кристаллов
 |
tпл Т
Рис.2.9. Температурная зависимость скоростей образования зародышей кристаллизации и роста кристаллов.
Для металлов мелкокристаллическая структура предпочтительнее – ей отвечают лучшие механические свойства. В ряде случаев, наоборот, требуется крупнокристаллическая структура. При очень быстром охлаждении расплава (для металлов скорость охлаждения должна быть порядка 106 оС/мин) можно получить любой материал в аморфном состоянии. Аморфные металлические ферромагнетики в настоящее время находят широкое применение. Знание кинетических закономерностей кристаллизации даёт возможность направленно изменять свойства материалов.
2.2. Термодинамика кристаллизации.
Мы познакомились с тем, как происходит кристаллизация. Попробуем разобраться в вопросе, почему происходит кристаллизация. Известно, что в природе самопроизвольно совершаются только те процессы, в результате которых уменьшается свободная энергия DF или энергия Гиббса DG. DG = DH - TDS
Возникновение и рост новой фазы относятся к тем явлениям, которые, строго говоря, невозможно описать методами классической термодинамики – они представляют термодинамический парадокс.
DG 

 0
0
r* r** r
 Рис.2.10. Изменение D G в процессе роста зародыша кристаллизации.
Рис.2.10. Изменение D G в процессе роста зародыша кристаллизации.
Появление зародыша размером r* (r* = 10 – 100Ао) необъяснимо термодинамически и происходит как флуктуационное явление. Переход от переохлаждённой жидкости к кристаллу размером r** сопровождается повышением свободной энергии системы в целом за счёт уменьшения энтропии.
Дальнейший рост кристалла сопровождается уменьшением энтальпии DН за счёт уменьшения свободной поверхности кристалла и образования связей между частицами (химических, электростатических, межмолекулярных). Одновременно продолжает уменьшаться энтропия, что должно препятствовать образованию кристалла (степень беспорядка уменьшается).
|
|
|
Для того, чтобы уменьшение энтропии не было настолько значительным, чтобы запретить рост кристалла, в кристалле образуются дефекты. В зависимости от конкретных условий формирующийся кристалл самопроизвольно приобретает тот вид дефектов, который при наименьших энергетических затратах обеспечивает максимальное увеличение энтропии по сравнению с идеальным кристаллом, где S = 0.
При повышении температуры порядок в расположении частиц нарушается, энтропия растёт и при ТDS > DH значение DG < 0, что соответствует самопроизвольному процессу плавления. При ТDS = DH значение DG = 0, что соответствует состоянию равновесия между кристаллом и расплавом. Отсюда Тпл = DН /DS.
Таким образом, идеальные кристаллы не только возникают с малой вероятностью, но и не имеют возможности роста при малых пересыщениях (переохлаждениях). Возможно, этим и объясняется широкая распространённость кристаллов с дислокациями – только не идеально построенные зародыши новой фазы растут с достаточно большими скоростями. Но вообще, наблюдаемая относительно высокая скорость возникновения зародышей новой фазы – это одна из нерешённых проблем современной термодинамики.
2.3. Правило фаз Гиббса, фазовые диаграммы.
Нелишне вспомнить некоторые известные из предыдущих курсов понятия.
 Фазой называют совокупность всех гомогенных частей системы, одинаковых во всех точках по составу и по всем химическим и физическим свойствам (не зависящим от количества) и отграниченных от других частей некоторой видимой поверхностью (поверхностью раздела). Так, например, в системе, состоящей из льда, воды и пара, все куски льда образуют одну фазу, вода – другую, а пар – третью. Здесь одно вещество – вода образует 3 фазы.
Фазой называют совокупность всех гомогенных частей системы, одинаковых во всех точках по составу и по всем химическим и физическим свойствам (не зависящим от количества) и отграниченных от других частей некоторой видимой поверхностью (поверхностью раздела). Так, например, в системе, состоящей из льда, воды и пара, все куски льда образуют одну фазу, вода – другую, а пар – третью. Здесь одно вещество – вода образует 3 фазы.
|
|
|


 Поверхности раздела фаз образуются некоторым количеством молекул, расположенных на границе области, заполненной данной фазой. Молекулы, образующие поверхностный слой, находятся в особых условиях, вследствие чего обладает свойствами (например, избыточной поверхностной энергией), не присущими веществу, находящимися в глубине фазы. Образования, составленные из небольшого числа молекул, не могут быть разделены на поверхностный слой и внутреннюю массу вещества, поэтому к образованиям с очень малым объёмом понятие фаза неприложимо (вспомните зародыши кристаллизации).
Поверхности раздела фаз образуются некоторым количеством молекул, расположенных на границе области, заполненной данной фазой. Молекулы, образующие поверхностный слой, находятся в особых условиях, вследствие чего обладает свойствами (например, избыточной поверхностной энергией), не присущими веществу, находящимися в глубине фазы. Образования, составленные из небольшого числа молекул, не могут быть разделены на поверхностный слой и внутреннюю массу вещества, поэтому к образованиям с очень малым объёмом понятие фаза неприложимо (вспомните зародыши кристаллизации).
Каждое вещество, которое может быть выделено из системы и может существовать вне её, называется составляющим веществом системы. Если в системе есть составляющие вещества, которые химически взаимодействуют друг с другом, образую другие вещества, то нет необходимости экспериментально определять концентрации всех составляющих веществ, т.к. состав фаз равновесной системы можно определить, зная концентрации лишь части составляющих веществ. Составляющие вещества, концентрации которых определяют состав фаз данной равновесной системы, называются независимыми составляющими веществами или компонентами системы.
Число компонентов или совпадает с числом составляющих веществ (при отсутствии химических реакций как в системе вода – лёд – пар) или меньше его. Число компонентов есть наименьшее число составляющих веществ, достаточное для определения состава любой фазы системы.
Между числом фаз (Ф) и числом компонентов (К) системы существует известное термодинамическое соотношение, которое называется «правилом фаз» Гиббса
С = К – Ф + n.
С – это число степеней свободы, т.е. число переменных, которым можно придавать произвольные значения при данном числе фаз, n – число внешних факторов (например, температура, давление, концентрация), влияющих на положение равновесия. Обычно n принимается равным двум – часто это температура и давление.
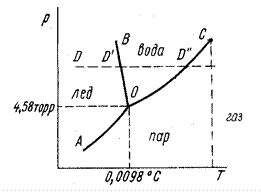
Рис. 2.11. Фазовая диаграмма однокомпонентной системы (вода).
 На рис. 2.11 представлена фазовая диаграмма однокомпонентной системы – воды – в координатах давление пара – температура. Диаграмма разбита на три области, каждая из которых охватывает все возможные сочетания Т и Р, отвечающие равновесному существованию определённой фазы. Пограничные линии принадлежат обеим соприкасающимся областям. В областях диаграммы, где существует только какая-либо одна фаза, правило фаз разрешает системе иметь две степени свободы: С = 1 – 1 + 2 = 2. При наличии двух фаз, когда интересующее нас состояние определяется точкой на какой-либо кривой, система будет иметь одну степень свободы: С = 1 – 2 + 2 = 1. В точке О, где сходятся все три пограничные линии, возможно одновременное существование всех трёх фаз. Не трудно подсчитать, что в этой точке (тройная точка) число степеней свободы равно нулю, т.е. ни температуру, ни давление изменять здесь нельзя: С = 1 – 3 + 2 = 0. Диаграмма показывает возможность непосредственного перехода газа в твёрдое тело и твёрдого тела в газ (сублимация).
На рис. 2.11 представлена фазовая диаграмма однокомпонентной системы – воды – в координатах давление пара – температура. Диаграмма разбита на три области, каждая из которых охватывает все возможные сочетания Т и Р, отвечающие равновесному существованию определённой фазы. Пограничные линии принадлежат обеим соприкасающимся областям. В областях диаграммы, где существует только какая-либо одна фаза, правило фаз разрешает системе иметь две степени свободы: С = 1 – 1 + 2 = 2. При наличии двух фаз, когда интересующее нас состояние определяется точкой на какой-либо кривой, система будет иметь одну степень свободы: С = 1 – 2 + 2 = 1. В точке О, где сходятся все три пограничные линии, возможно одновременное существование всех трёх фаз. Не трудно подсчитать, что в этой точке (тройная точка) число степеней свободы равно нулю, т.е. ни температуру, ни давление изменять здесь нельзя: С = 1 – 3 + 2 = 0. Диаграмма показывает возможность непосредственного перехода газа в твёрдое тело и твёрдого тела в газ (сублимация).
|
|
|
Существует ещё одно состояние – промежуточное между жидким и газообразным. При высоких температурах и давлениях, например, при нагревании жидкости в герметически закрытом сосуде, вследствие расширения жидкости её плотность будет уменьшаться, а плотности паров над её поверхностью будет возрастать и когда их плотности уравняются, исчезнет граница раздела. Д.И. Менделеев в 1861 г. установил, что для каждой жидкости существует область температур и давлений, при которых исчезает всякое различие между жидкостью и её паром. Такое состояние называют сверхкритическим. В настоящее время интенсивно развивается направление, связанное со сверхкритическим оксидом углерода СО2.
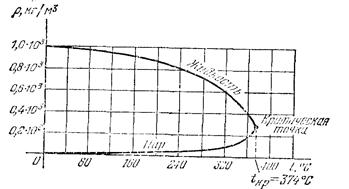
Рис. 2.10.
Изменение плотности воды и водяного пара, находящихся в герметически закрытом сосуде, в зависимости от температуры.
Для системы из двух компонентов правило фаз даёт следующие значения степеней свободы:
С = 2 – 1 + 2 = 3 при Ф = 1
С = 2 – 2 + 2 = 2 при Ф = 2
С = 2 – 3 + 2 = 1 при Ф = 3
С = 2 – 4 + 2 = 0 при Ф = 4
Наибольшее число степеней свободы, равное 3, имеет однофазная система. Следовательно, в этом случае можно произвольно устанавливать и менять три условия: температуру, давление и концентрацию одного из компонентов.
|
|
|
В конденсированных системах (жидкое и твёрдое состояния, например, расплав – твёрдое состояние) изменение давления незначительно сказывается на свойствах, поэтому давление можно считать постоянным и уравнение примет вид С = К – Ф + 1, а фазовая диаграмма (в случае образования твёрдого раствора) будет иметь вид, представленный на рис. 2.5. Следовательно, двухкомпонентная конденсированная система в гомогенной области, где одна фаза, должна иметь 2 степени свободы, т.е. состояние системы определяется температурой и концентрацией одного из компонентов. Если двухкомпонентная система двухфазна, то степеней свободы будет одна. Это обозначает, что при изменении температуры изменяется концентрация обеих фаз. Типичная фазовая диаграмма двухкомпонентной системы (сплав двух металлов) представлена на рис. 2.12. Здесь в области выше кривых (область «L») система однофазна и представляет собой расплав компонентов А и В. В этой области можно изменять концентрацию компонентов и температуру. Если систему произвольного состава охлаждать, то при достижении температуры, отвечающей точке на кривой ликвидуса, начнётся выделение кристаллов того компонента, к которому примыкает данная ветвь линии ликвидуса. По мере выпадения кристаллов этого компонента (например, компонента А) расплав будет обогащаться компонентом В и процентное содержание его будет возрастать, а компонента А - уменьшаться. При дальнейшем снижении температуры состав расплава будет изменяться по ветви ликвидуса, относящейся к компоненту А до точки C. В этой точке происходит выделение кристаллов обоих компонентов. Сплав этого состава называется эвтектическим. Эта точка соответствует одновременному существованию трёх фаз – одной жидкой и двух твёрдых (кристаллических). Соответственно, число степеней свободы равно нулю (конденсированные фазы).

Рис.2.12. Фазовая диаграмма двухкомпонентной системы, не образующей твёрдых растворов.
В области диаграммы АСD одновременно присутствуют жидкая фаза и кристаллы А. Соответственно в области ВСЕ присутствуют жидкая фаза и кристаллы В.
Если же в твёрдом состоянии наблюдается частичная растворимость компонентов (ограниченные твёрдые растворы), то фазовая диаграмма принимает вид как на рис. 2.13.

Рис. 2.13. Фазовая диаграмма двухкомпонентной системы с ограниченной взаимной растворимостью компонентов в твёрдом состоянии.
Здесь в области α находится твёрдый раствор замещения с преобладанием компонента А, а в области β - твёрдый раствор замещения с преобладанием компонента В.
Разделения фаз, описываемые фазовыми диаграммами, имеют место в процессах синтеза полимеров, в процессах выделения веществ из смеси, в процессах формования полимерных структур, в процессах нанесения покрытий различной природы и к этим вопросам мы вернёмся в дальнейшем.
2.4. Процессы структурообразования.
При охлаждении расплава вещества, способного к кристаллизации, в зависимости от скорости охлаждения могут образовываться как кристаллические, так и аморфные (стеклообразные) структуры. Если кристаллизация началась, то кристаллы растут до тех пор, пока они не соприкоснутся своими краями друг с другом. При этом всё (или практически всё) вещество закристаллизовывается. Форма образующихся кристаллов может быть разнообразна. Для полимеров характерна кристаллизация в форме сферолитов.
При кристаллизации из раствора образуются индивидуальные кристаллы, форма которых зависит от многих факторов: температуры, степени пересыщения, природы растворителя, перемешивания, наличия растворимых примесей, нерастворимых примесей, готовой кристаллической поверхности, а также электрического поля, магнитного поля, радиоактивных излучений. В первую очередь перечисленные факторы влияют на скорость образования зародышей кристаллизации, а после возникновения устойчивых зародышей – на морфологию растущих кристаллов. (Морфология – от греч. мorphe - форма, учение о формах и строении)
Рост кристаллов из раствора включает целый ряд этапов: 1) подвод вещества к поверхности грани; 2) образование двухмерных зародышей, а также их рост; 3) отвод молекул растворителя, не вошедших в состав растущего кристалла, от его поверхности в объём среды; 4) отвод тепла, выделяющегося при кристаллизации.
При очень малых пересыщениях кристалл растёт главным образом в результате присоединения отдельных частиц (ионов или молекул) к местам нарушений кристаллической решётки: на молекулярных террасах, ступеньках и т.п. С уменьшением степени пересыщения раствора происходит выравнивание скоростей роста отдельных граней кристаллов и он оказывается огранённым б о льшим числом плоскостей, более равномерно развитых.
С увеличением степени пересыщения увеличивается разница в скоростях роста отдельных граней, а также общая скорость роста кристалла. При большом пересыщении возможно одновременное образование и разрастание нескольких плоских зародышей в различных местах одной и той же грани. В результате могут образовываться дефектные кристаллы, содержащие даже включения маточного раствора.
Высокое пересыщение раствора способствует и образованию дендритных (ветвистых, подобных узорам мороза на окнах) форм роста. Это объясняется более лёгким притоком кристаллизующегося вещества к вершинам кристалла. Росту дендритов также способствует отсутствие перемешивания, кристаллизация из вязких растворов, присутствие примесей, особенно поверхностно-активных веществ.
Перемешивание раствора облегчает процесс диффузии вещества из объёма среды к граням кристалла и ускоряет его рост. Благодаря этим наблюдениям была решена задача скоростного выращивания монокристаллов сегнетовой соли в промышленных условиях путём вращения затравочного кристалла в пересыщенном растворе. Скорость роста кристаллов в зависимости от скорости вращения кристалла вначале резко увеличивается, а затем довольно плавно достигает определённого предела, выше которого перемешивание бесполезно, а иногда и вредно. При перемешивании раствора обеспечивается равномерный приток кристаллизующегося вещества к различным граням, что способствует образованию кристаллов правильной формы.
С повышением температуры скорость роста кристаллов резко увеличивается. Это объясняется ускорением диффузионных процессов, увеличением коэффициента диффузии D, уменьшением толщины ламинарного слоя маточного раствора на поверхности кристалла.
Присутствие в растворе даже ничтожно малого количества примесей может оказывать существенное влияние на скорость роста отдельных граней кристалла, его форму, окраску, однородность. Некоторые примеси могут полностью приостановить рост кристалла даже при больших пересыщениях раствора, другие, наоборот, могут вызвать укрупнение кристаллов в процессе массовой кристаллизации.
При кристаллизации из газовой фазы вещество обычно кристаллизуется в дендритные формы. Примером могут служить снежинки, всегда имеющие гексагональный узор. В них из центрального ядра к периферии растут шесть лучей, которые затем разветвляются снова и снова, сохраняя общую гексагональную симметрию. Разнообразие ветвистых узоров снежинок неописуемо. Американский учёный У. Бентли много лет фотографировал снежинки и результаты этой кропотливой работы опубликовал в прекрасной книге, содержащей сотни фотографий (1931 г.).
Аналогично образуются дендритоподобные кристаллы металлов при разложении карбонилов металлов. Но, из-за большой массы (всё же металл, а не вода) происходит быстрое укрупнение частиц, которые в результате приобретают сферическую форму. Первоначальный размер частиц – несколько десятков ангстрем, что соответствует 102 – 103 атомов. Малый размер и неупорядоченность «первичных частиц» металла придают им огромные избытки энергии по сравнению с компактным стабильным металлом. Поэтому коагуляция этих частиц сопровождается их быстрым слиянием.
Рыхлые хлопьевидные структуры образуются также при газофазной полимеризации.
Специфической и очень важной областью является нанесение вещества на подложку. В этом случае внешней средой может быть газообразная, жидкая или твёрдая фаза, а подложкой является всегда твёрдая фаза в виде моно-, поликристаллического или стеклообразного вещества или в виде композиционного материала. Примеров таких покрытия множество. Это металлические покрытия металлов и неметаллов, защитные (и декоративные) полимерные покрытия самых разнообразных материалов, композиционные покрытия различной природы, стекловидные неорганические покрытия и многие другие. В микроэлектронике огромное значение имеют эпитаксиальные покрытия.
2.4.1. Эпитаксия (от греческого еpi – на и taxis – расположение в порядке) – это процесс ориентированного нарастания, в результате которого образующаяся новая фаза закономерно продолжает кристаллическую решётку фазы – подложки с образованием переходного эпитаксиального слоя, при этом происходит срастание двух решёток по плоскостям и направлениям со сходной плотностью упаковки атомов.
Между двумя срастающимися фазами – подложкой и нарастающей фазой, образуется переходный эпитаксиальный слой (ПЭС), структура и химический состав которого определяется характером физико-химического взаимодействия в данной системе. В этом слое начинается и заканчивается собственно процесс эпитаксии.
Если структура срастающихся веществ подобна не только по строению кристаллических решёток, но и по характеру и типу связей атомов, её образующих, то такой процесс называют автоэпитаксия Обычно это бедные твёрдые растворы одного и того же вещества, например, р- и n-кремний. В этом случае образуется гомогенный электронно-дырочный переход.
Если химическая природа срастающихся фаз различна, но они не образуют друг с другом химических соединений, то такой процесс называют гетероэпитаксией. В этом случае формируется гетерогенный электрический переход, способный выполнять функции дискретных приборов. Примерами могут служить эпитаксиальные слои арсенида галлия GaAs на фосфиде галлия GaP, арсенида галлия на селениде цинка ZnSe и др.
Если при наращивании происходит химическое взаимодействие вещества подложки с веществом, поступающим из внешней среды, то такой процесс носит название хемоэпитаксия. Полученное соединение отличается по химическому составу как от вещества подложки, так и от вещества, поступающего из внешней среды. Образующаяся фаза продолжает кристаллическую решётку подложки. Толщина хемоэпитаксиального слоя мала. Такие структуры могут образовывать как гетеропереход, так и невыпрямляющий контакт.
Во всех рассмотренных выше случаях рост новой фазы ориентируется структурой кристаллической решётки подложки. Возможно неориентированное (произвольно ориентированное) нарастание слоёв. В этом случае плёнка удерживается на поверхности подложки только силами межмолекулярного взаимодействия. При этом подложки могут быть моно-, поликристаллическими и стеклообразными, а нарастающая на них плёнка – поликристаллической или стеклообразной (аморфной).
Плёнка какой структуры (кристаллической или аморфной) будет образовываться при эпитаксиальном наращивании зависит от кинетики образования зародышей кристаллизации и роста кристаллов и степени переохлаждения. Ранее мы приняли, что обычно скорость роста кристаллов максимальна вблизи от Тпл, а максимум скорости образования зародышей кристаллизации – при более сильных переохлаждениях. В действительности встречаются и другие варианты. Так, для селена температура максимальной скорости роста кристаллов существенно ниже максимума скорости образования зародышей кристаллизации. В результате селеновые плёнки для выпрямителей всегда аморфны. Напротив, стеклообразующие вещества типа оксида кремния SiO2 или германия GeO2 и ряд других имеют максимальную скорость образования зародышей кристаллизации намного ниже Тпл, когда скорость роста кристаллов пренебрежительно мала. В результате такие материалы практически всегда находятся в стеклообразном состоянии.
На процесс ориентированного наращивания влияют как внешние (технологические) факторы (качество подготовки поверхности подложки, температура, давление, концентрации и др.), так и внутренние факторы – характер физико-химического взаимодействия срастающихся веществ, отражающийся в диаграммах фазовых равновесий системы подложка – нарастающее вещество – примесь, электронное строение взаимодействующих атомов, структурно-геометрический фактор, температуры плавления и кипения и многие другие.
Переходный эпитаксиальный слой (ПЭС) в случае гетероэпитаксии представляет собой твёрдый раствор. Толщина ПЭС определяется внешними факторами и зависит от диаграммы состояния данной системы. Чем меньше концентрационная область существования твёрдых растворов, тем тоньше ПЭС.
Эпитаксия, выражающаяся во влиянии подложки на морфологию кристаллов, наблюдается и в полимерах.
Кристаллизация полимеров
Вообще, кристаллизация полимеров имеет существенные отличия от кристаллизации низкомолекулярных веществ в силу особенностей их молекулярного строения, а именно – анизометричности, т.е. огромных различий в поперечных и продольных размерах макромолекул. Возможность кристаллизации полимеров зависит от структуры их макромолекул. В первую очередь имеет значение регулярность строения макромолекул, причём не только регулярность чередования атомов, но и регулярность их расположения в пространстве. Так, полиэтилен –[CH2 – CH2]n и политетрафторэтилен –[CF2 – CF2]n- имеют строго регулярное строение (мономерные звенья симметричны) и поэтому способны кристаллизоваться. А уже полипропилен –[CH2-CH(CH)3]n- кристаллизуется только тогда, когда макромолекула имеет стереорегулярное строение. На рис. 2.13 представлена конформация молекулы изотактического полипропилена, а на рис. 2.14 – проекция моноклинной элементарной ячейки полипропилена.
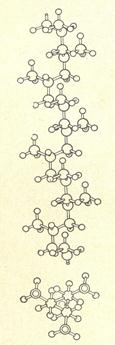
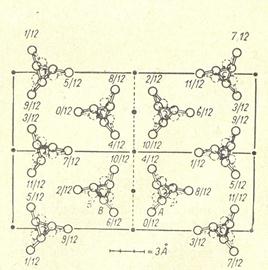
Рис. 2.13. Конформация макромолекулы изотактического полипропилена.
Рис. 2.14. Проекция моноклинной элементарной ячейки полипропилена на плоскость, перпендикулярную оси макромолекулы. (Изображены только атомы С).
Макромолекула полипропилена (как и многих других подобных полимеров) имеет форму спирали, в которой боковые заместители R могут быть расположены различным образом. Если представить основную цепь полипропилена в виде плоского зигзага, то возможные конфигурации макромолекулы будут выглядеть так, как изображено на рис. 2.15.

Рис. 2.15. Возможные конфигурации макромолекул полиолефинов.
а – изотактический; б – синдиотактический; в – атактический.
Стереорегулярным строением будут обладать изотактические и синдиотактические формы и именно такого строения макромолекулы способны кристаллизоваться. Полимер атактического строения не кристаллизуется.
Как видно из рисунка 2.14, отличием полимерных кристаллов от кристаллов низкомолекулярных веществ является то, что в узлах решётки находятся не отдельные атомы (шарики), а макромолекулы, распложены в кристалле так, как изображено на рис. 2.16.
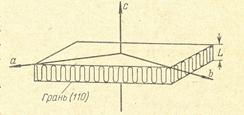
Рис. 2.16. Схема расположения кристаллографических осей в пластинчатом кристалле полиэтилена. L – это толщина складки.
2.5. Надмолекулярная структура полимеров.
В разбавленных растворах макромолекулы гибкоцепных полимеров приобретают глобулярную форму – форму статистических клубков. По мере увеличения концентрации (например, при испарении растворителя) клубки начинают разворачиваться. При этом участки цепей смежных клубков вынуждены укладываться параллельно и не обязательно «снопиком». Макромолекуле термодинамически выгодно многократно складываться самой на себя. Упакованные в пачки эти складчатые структуры называют кристаллитами. Кристаллиты являются минимальными дискретными элементами любой устойчивой надмолекулярной организации в твёрдых полимерах. А из кристаллитов образуются ламелярные кристаллы, монокристаллы, эдриты, аксиалиты, фибриллы, сферолиты. Для сравнения приведём их характерные размеры в ангстремах (1А = 10-10м)
Наименьший Наибольший
размер размер
Макромолекула 2 – 5 103 - 105
Кристаллит 20 – 100 100 – 500
Ламелярный кристалл до 100 104 - 105
Монокристалл 100 104 - 105
Эдриты, аксиалиты 102 - 104 104 - 106
Фибриллы 103 – 105 105 - 106
Сферолиты 105 - 107 Более 107
Ламелярный кристалл – это тонкий пластинчатый кристалл. Монокристаллы обычно имеют вид полой четырёхгранной пирамиды. Полимерные монокристаллы удаётся вырастить только из разбавленных растворов путём их охлаждения. Эдриты и аксиалиты – это многогранные структуры. Эдриты – это образования, в которых хотя бы одна из проекций имеет вид многогранника. Аксиалиты имеют анизодиаметрическую форму. Граница между аксиалитами и эдритами условна, поэтому часто их называют одним термином, например, эдритами. Эти кристаллы занимают по сложности своего строения промежуточное положение между монокристаллами и сферолитами. Фибриллы – это кристаллы, по внешнему виду напоминающие плоские ленты. Из них строятся сферолиты – наиболее типичная форма кристаллизации полимеров как из раствора, так и из расплава.
Сферолиты – это весьма сложные и совершенные надмолекулярные кристаллические образования, формирующиеся на глубоких стадиях кристаллизации. Они представляют собой трёхмерное образование, симметричное относительно центра. В тонких плёнках диаметр сферолита может быть больше толщины плёнки и тогда образуется «двухмерный сферолит», представляющий собой фактически шаровой слой, вырезанный поверхностями плёнки из трёхмерного сферолита. Практическое значение имеет изучение стадий и механизмов образования сферолитов, расположение макромолекулярных цепей в сферолитах, поведение сферолитов в процессе деформирования полимеров и влияния их на свойства полимерных материалов.
Изучение структуры кристаллических полимеров, их смесей, в том числе и изоморфно-замещённых смесей полимеров, до, в процессе вытягивания и после вытягивания позволило определить механизм деформирования, заключающийся в рекристаллизации полимера в силовом поле. Суть этих представлений заключается в разрушении, «расплавлении» кристаллов под действием больших напряжений, ориентации макромолекул относительно оси растяжения и их последующей кристаллизации, закрепляющей эффект ориентации.



|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 948; Нарушение авторских прав?; Мы поможем в написании вашей работы!