
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Е л е к т р о д н і п о т е н ц і а л и
|
|
|
|
Електрохімія
План
КОРОЗІЙНІ ПРОЦЕСИ В ЕЛЕМЕНТАХ СЕУ ТА ПРИСТРОЯХ
Практичне заняття 3
Контрольні питання
LIQUITREAT- це рiдка сумiш лужних сполук
1. З якою метою в замкнутих контурах охолоджуючих систем дизелів використовують хімічні препарати DIESELGUARD NB і ROCOR NB LIQUID фірми UNITOR?
2.Назвіть межі дотримання (ppm) параметрів охолоджуючої води дизелів при використанні препаратів DIESELGUARD NB і ROCOR NB LIQUID.
3. Яку кількість препарату ROCOR NB уводять в систему охолодження дизеля при ii первинному заповненні?
4. Назвіть основні задачі хімічного контролю охолоджуючої води ДВЗ.
5. Який тип накипу відкладається на поверхнях зарубашечноi порожнини системи охолодження дизеля, що заповнена дистилятом?
6. Як часто та за допомогою якої експрес-лабораторії здійснюється контроль якостi води в системі охолодження?
7. Що розуміють під терміном «пом’якшення води»?
8. При яких значеннях водневого показника рН процес кисневої корозії протікає особливо інтенсивно?
9.Який із показників якості живильної або котлової води неможливо визначити за допомогою лабораторного набору фірми UNITOR SPECTRAPAK 310?
10. До яких наслідків призводить завищений рівень величини рН у котловій воді?
11.З якою метою в процесі водообробки парових котлів застосовують хімічні реактиви фірми UNITOR COMBITREAT, LIQUITREAT і AUTOTREAT?
12. До чого зводяться основні задачі хімічного контролю котлової води? 13. Величина яких параметрiв визначаэ необхідність продування котла?
14. Про що свідчить поступове або раптове збільшення концентрації хлоридів Cl – у котловій воді?
15. Яким шляхом досягається забезпечення необхiдного водного режиму СПК?
16.Назвiть фiзико-хiмiчнi властивостi розглянутих в данiй роботi препаратiв для обробки котловоi води та води систем охолодження дизелiв.
|
|
|
17.Назвiть призначення та сферу застосування тестових комплектiв SPECTRAPAK 309 та SPECTRAPAK 310.
1. Електрохімія
2. Корозія металів
3. Захист металу від корозії
4. Контрольні питання
За визначенням академіка А.Н. Фрумкіна електрохімія охоплює всі форми взаємодії між рухливими зарядженими частинками у конденсованих фазах як у стані рівноваги, так і під час протікання реакцій на границі розділу і в об’ємі фаз. Іншими словами електрохімія охоплює області взаємного перетворення хімічної та електричної енергії /16/.
Розглянемо процеси, які відбуваються на границі розподілу фаз «метал-вода» /12/. У металі існує рухлива рівновага між нейтральними атомами металу Ме, його позитивними іонами Ме, які складають основу кристалічної решітки, та вільними електронами n, що знаходяться у міжвузловинах (див. рис. 1.1).
Ме Ме n+ + ne-


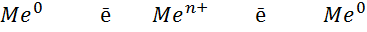
Рис. 1.1 – Кристалічна решітка металу
Після занурення на металу у воду відбувається орієнтація полярних молекул води на границі розділу фаз, особливо у тих місцях де знаходиться заряжені іони металу і можливий вихід акватированого іона у рідку фазу (див. рис. 1.2).

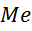



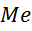


Рис. 1.2. – Орієнтація полярних молекул води на границі розділу фаз
| _ + |
де – диполь молекули води
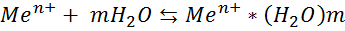
Сумарний процес на границі розділу фаз:
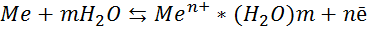
Вільні електрони у розчин не переходять. Вони залишаються на металі, концентруючись у поверхневому шарі і надають металу загальний негативний заряд, до якого притягаються позитивні іони металу, які перейшли у розчин. При наявності стану рівноваги подвійний електричний шар (ПЕШ) та дифузійну частину, в якій іони можуть вільно переміщатися (див. рис. 1.3).
Метал ПЕШ Розчин
- + +
- + +
- + φ
- + + +
- + +
Рис. 1.3 – Утворення електродного (електрохімічного) потенціалу при зануренні металу у воду
|
|
|
Потенціал φ, що при цьому утворюється, називають електродним, або електрохімічним потенціалом. Цей потенціал залежить від природи речовини, температури та концентрації іонів металу у розчині і визначається рівнянням Нернста:
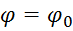 +
+ 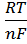 · lnC
· lnC
За температури t = 25°С концентрація іонів металу С = 1г · моль / л, де г · моль – число грамів речовини, що дорівнює її молекулярній масі;
R = 8,31 Дж / (моль · °С) – універсальна газова стала;
F = 96500 Кл / моль – число Фарадея;
n – валентне число іонів речовини.
За С = 1г · моль / л 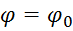 , де
, де 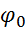 – стандартний електродний потенціал (СЕП).
– стандартний електродний потенціал (СЕП).
Стандартний електродний потенціал 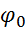 (СЕП ) є кількісною мірою активності металу.Чим активніший метал, тим легше він віддає електрони, тим більше в його решітці іонів і тим більше іонів переходять у розчин, тим менша алгебраїчна величина його стандартного електродного потенціалу
(СЕП ) є кількісною мірою активності металу.Чим активніший метал, тим легше він віддає електрони, тим більше в його решітці іонів і тим більше іонів переходять у розчин, тим менша алгебраїчна величина його стандартного електродного потенціалу 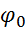 (СЕП).
(СЕП).
За нульовий електродний потенціал приймається величина СЕП водневого газового електрода, де на поверхні «газ-розчин» має місце рівновага:
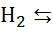 2
2  + 2е
+ 2е
Водневий газовий електрод являє собою дрібнодисперсну платину насичену газоподібним воднем на твердій платині, яка занурена у розчин одно нормальної кислоти (С = 1г - екв / л).
За величиною СЕП усі метали розподілені у шкалі стандартних електродних потенціалів (шкала СЕП), або в ряд активності металів по мірі зменшення їхньої активності (див. табл. 1. 1).
Таблиця 1.1. – Шкала СЕП (ряд активності металів)
| Назва і позначення металу | Вища ступінь окислення | + n 
| Нища ступінь окислення | 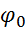 , В , В
|
| Літій, Li | 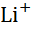
| 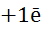
| 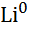
| - 3,045 |
| Калій, K | 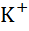
| 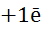
| 
| - 2,92 |
| Кальцій, Ca | 
| 
| 
| - 2,86 |
| Натрій, Na | 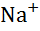
| 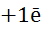
| 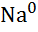
| - 2,71 |
| Магній, Mg | 
| 
| 
| - 2,36 |
| Алюміній, Al | 
| 
| 
| - 1,66 |
| Марганець, Mn | 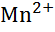
| 
| 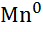
| - 1,18 |
| Хром, Cr | 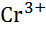
| 
| 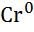
| - 0,91 |
| Цинк, Zn | 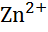
| 
| 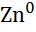
| - 0,76 |
| Залізо, Fe | 
| 
| 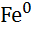
| - 0,44 |
| Кадмій, Cd | 
| 
| 
| - 0,40 |
| Кобальт, Co | 
| 
| 
| - 0,27 |
| Нікель, Ni | 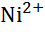
| 
| 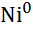
| - 0,25 |
| Олово, Sn | 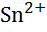
| 
| 
| - 0,136 |
| Свинець, Pb | 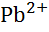
| 
| 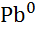
| - 0,126 |
Водень, 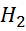
| 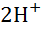
| 
| 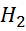
| 0,000 |
| Вісмут, Bi | 
| 
| 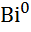
| + 0,215 |
| Мідь, Cu | 
| 
| 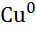
| + 0,34 |
| Серебро, Ag | 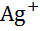
| 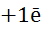
| 
| + 0,799 |
| Ртуть, Hg | 
| 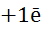
| 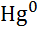
| + 0,85 |
| Золото, Au | 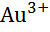
| 
| 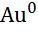
| + 1,498 |
Позитивні потенціали виникають на малоактивних металах, занурених у розчин їхніх солей з концентрацією іонів С = 1г · моль / л (одномолярний розчин) завдяки переходу іонів металу не в розчин, а навпаки, за рахунок виділення цих іонів на металі. Якщо ж опускати метал у чисту (знесолену) воду, то перехід іонів металу у розчин стає можливим.
|
|
|
У побудову шкали СЕП закладенні наступні положення:
- метали розміщені у шкалі СЕП (у ряду активності металів) в порядку убування їхньої хімічної активності, тобто у порядку збільшення алгебраїчної величини СЕП;
- кожний метал здатний витіснити із розчину солі любий інший метал, який має більшу алгебраїчну величину СЕП. Так, якщо у розчин солі міді занурити залізний цвях або пластинку цинку, то вони витіснять мідь із розчину її солі, після чого ця мідь відкладеться на поверхні залізного цвяха або цинкової пластинки, про що свідчить зміна характерного кольору цих поверхонь на рожево-червоний.
 Fe + CuS
Fe + CuS 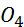 = FeS
= FeS 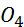 + Cu
+ Cu

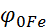 <
< 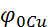
 Zn + CuS
Zn + CuS 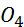 = ZnS
= ZnS 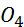 + Cu
+ Cu

 <
< 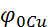 ;
;
- метали з негативними значеннями СЕП розчиняються в кислотах з виділенням водню: Zn + 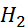 S
S 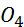 = ZnS
= ZnS 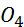 +
+ 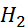 ↑; Fe+ HCl = FeCl +
↑; Fe+ HCl = FeCl + 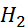 ↑;
↑;
- метали, що мають позитивне значення СЕП в кислотах із виділенням водню не розчиняються (Ag, Hg, Au);
- активні метали, що стоять в ряду активності до цинка Zn виділяють водень із води: Na + 2 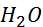 = 2NaOH +
= 2NaOH + 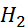 ↑.
↑.
1.2. Г а л ь в а н і ч н і е л е м е н т и. Е л е к т р о р у ш і й н а с и л а (Е Р С)
Якщо взяти два різні електроди (електрод – це метал, занурений у розчин його солі) і замкнути систему, то отримаємо джерело електричного струму, електрорушійну силу (ЕРС), або гальванічний елемент. При цьому потрібно врахувати те, що метали замикаються металами, а розчини – розчинами за допомогою електролітичного ключа (скляна зогнута трубочка, заповнена розчином KCl) або напівпроникненої перегородки.
Розглянемо роботу мідно-цинкового гальванічного елемента (елемента Даніеля). Електрод, на якому буде відбуватися відновлення, тобто приймання електронів, буде катодом, а на аноді буде протікати процес окислення, тобто віддача електронів. Тому більш активний метал, з меншою алгебраїчною величиною СЕП (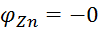 ,76В), завжди буде анодом, а менш активний метал, з більшою величиною СЕП (
,76В), завжди буде анодом, а менш активний метал, з більшою величиною СЕП (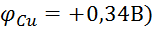 , - катодом. Фактично відбувається витіснення активним металом менш активного, але при цьому процеси розділені у просторі.
, - катодом. Фактично відбувається витіснення активним металом менш активного, але при цьому процеси розділені у просторі.
|
|
|
Схема гальванічного елемента Даніеля та хімічні реакції, що протікають в ньому показані на рис. 1.4.
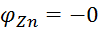 ,76В
,76В
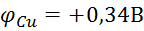
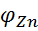 (Анод) <
(Анод) < 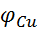 (катод)
(катод)
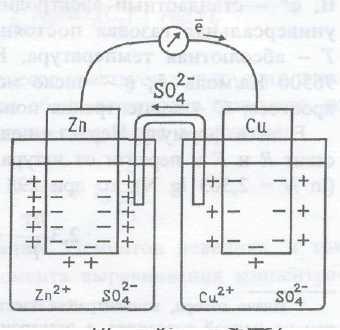
Рис. 1.4 – Гальванічний елемент Даніеля

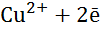 =
= 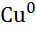
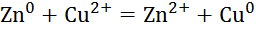
Zn+ CuS 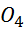 = ZnS
= ZnS 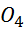 +
+ 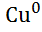 .
.
Схема гальванічного елемента (рис. 3.4) може бути представлена наступним чином:
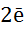
Zn | ZnS 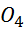 || CuS
|| CuS 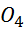 | Cu
| Cu
Тут однією рискою | позначена границя розділу між твердою та рідкою фазами, а двома рисками || позначена границя розділу між рідкими фазами.
ЕРС = 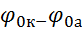 = 0,34 – (- 0,76) = 1,1В (для одномолярних розчинів ЕРС > 0 завжди).
= 0,34 – (- 0,76) = 1,1В (для одномолярних розчинів ЕРС > 0 завжди).
З початком роботи гальванічного елемента рівновага на границі розділу фаз «тверде – рідке» порушується і визначається тепер швидкістю процесів, що відбуваються на електродах: сольватація (гідратація) іонів на поверхні метала ті перехід іонів у розчин, їх дифузія у середину розчину – на аноді; асиміляція електронів іонами та їхнє перетворення в нейтральні атоми з наступною вбудовою у кристалічну решітку, дифузія іонів із розчину до електрода – на катоді і т.д. Тому потенціали електродів змінюються, відбувається так звана поляризація електродів.
Алгебраїчна величина анодного потенціалу збільшується:
 =
= 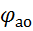 + Δ
+ Δ 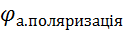
Алгебраїчна величина катодного потенціалу зменшується:
 =
=  + Δ
+ Δ 
Тому ЕРС гальванічного елемента падає і дорівнює розрахунковій тільки в момент замикання:
ЕРС = 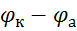 =
= 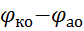 + Δ
+ Δ  – Δ
– Δ  .
.
Елемент працює до тих пір, доки не розчиниться увесь метал на аноді, або до тих пір, поки не виділиться із розчину весь метал і не осяде на катоді.
Виділення речовин на електродах визначається потенціалами виділення 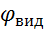 . Ці потенціали містять в собі напругу на подолання електродних потенціалів
. Ці потенціали містять в собі напругу на подолання електродних потенціалів 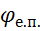 , на подолання поляризації Δ
, на подолання поляризації Δ  , та омічного опору розчину
, та омічного опору розчину  .
.
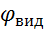 =
= 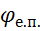 +
+ 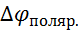 +
+  .
.
Надлишок потенціалу (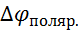 +
+  ) над електродним потенціалом називають перенапруженням. Особливо велике перенапруження має водень. Воно досягає 1,2В і тому водень виділяється не після міді, а після цинку.
) над електродним потенціалом називають перенапруженням. Особливо велике перенапруження має водень. Воно досягає 1,2В і тому водень виділяється не після міді, а після цинку.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 446; Нарушение авторских прав?; Мы поможем в написании вашей работы!