
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ацидиметрия
|
|
|
|
Титрование сильного основания сильной кислотой
При титровании сильного основания сильной кислотой, например, гидроксида натрия раствором хлороводородной кислоты, протекают процессы, аналогичные рассмотренным при титровании сильной кислоты сильной щёлочью, но только в обратном порядке. При прибавлении титранта к исходному раствору значение рН раствора уменьшается. Расчёт проводится по формулам. аналогичным рассмотренным выше (с.), для исходного раствора
рН =14 – рОН = 14 + lg
В точке эквивалентности рН=7, так как гидролиз соли отсутствует, после точки эквивалентности величина рН обусловлена присутствием избыточного титранта, то есть сильной кислоты. Точка эквивлентности совпадает в данном случае с точкой нейтральности. На рис. 3 показана в качестве примера кривая титрования 0,1 раствора гидроксида натрия 0,1 молярным раствором хлороводородной кислоты.
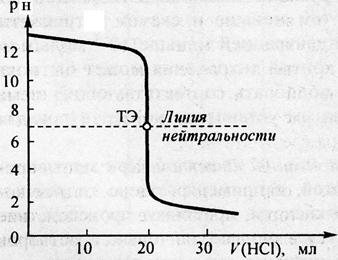
Рис.3 Рассчитанная кривая титрования 20 мл 0,1 моль/л раствора NaOH 0,1 моль/л раствором HCl
Титрование слабого основания сильной кислотой
Рассмотрим титрование гидрата аммиака хлороводородной кислотой.
В растворе гидрата аммиака устанавливается следующее протолитическое равновесие:
Исходный раствор имеет рН больше 7 и значение рН рассчитывается по формулам:
При прибавлении к раствору аммиака сильной кислоты, например, HCl
Образуется соль, содержащая катион слабого основания
После начала титрования в растворе присутствует как само слабое основание, так и его соль, то есть раствор представляет собой буферную смесь.
Расчёт рН выполняется по формулам:
Где К = 10-14
А К - константа кислотности кислоты, сопряжённой с титруемым основанием.
|
|
|
В точке эквивалентности источником оксония иона является сопряжённая кислота
За точкой эквивалентности значение рН определяется только добавленной сильной кислотой, то есть
рН= -lg

Рис.4. Рассчитанная кривая титрования 20 мл 0,1 моль/л раствора аммиака 0,1 моль/л раствором HCl
Рассматривая кривую титрования, мы видим, что точка эквивалентности лежит ниже линии нейтральности, величина скачка (от рН= 7,5 до рН= 3) значительно меньше, чем при титровании сильной щёлочи сильной кислотой (см. предыдущий рис.).
Для определения конечной точки титрования могут быть использованы следующие индикаторы: метиловый оранжевый (рТ =4), метиловый красный (рТ= 5,5) и другие см. таблицу. Фенолфталеин в данном случае использовать нельзя, так как у него рТ =9, что выходит за пределы скачка.
Титрование солей слабых кислот
Как было отмечено выше на с по теории Брёнстеда кислотные остатки слабых кислот являются основаниями, следовательно они могут присоединять протоны и могут быть оттитрованы растворами сильных кислот. Например, рассмотрим титрование ратвора карбоната натрия раствором хлороводородной кислоты. При растворении карбоната натрия в воде происходят следующие процессы:
Карбонат натрия как сильный электролит в воде диссоциирует нацело, а карбонат ион в растворе гидролизуется
Расчёт рН исходного раствора проводится по формуле:
На кривой титрования фиксируется два скачка титрования, которым соответствуют две точки эквивалентности. Первая из них связана с образованием амфолита – гидрокарбоната натрия. Расчёт рН амфолита проводится по формуле:
рН = ½(pK1+ pK2)
От первой до второй точки эквивалентности расчёт проводится по формуле
Во второй точке эквивалентности карбонат натрия полностью оттитрован до угольной кислоты, которая диссоциирует как слабая одноосновная кислота и расчёт рН проводится по формуле
|
|
|
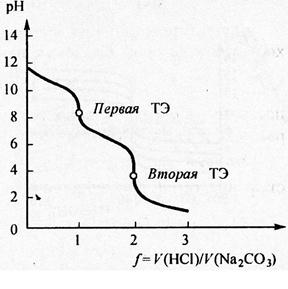
Рис.5.Расссчитанная кривая титрования раствора карбоната натрия Na2CO3 с молярной концентрацией эквивалента 0,1 моль/л раствором HCl с молярной концентрацией 0,1 моль/л; f – степень оттитрованности.
Величина рН после второй точки эквивалентности определяется значением избытка прибавленной кислоты (см. рис.). Для фиксации конечной точки титрования первой точки используется фенолфталеин, для фиксации второй точки титрования – метиловый оранжевый.
Титрование многоосновных кислот
Многоосновные кислоты, например, ортофосфорная диссоциируют последовательно, ступенчато. Константа диссоциации по первой ступени всегда больше константы диссоциации по второй, а константа диссоциации по второй ступени всегда больше константы диссоциации по третьей ступени.
Диссоциация кислот по первой ступени подавляет диссоциацию кислот по последующим ступеням. Поэтому при титровании растворов многоосновных кислот растворами сильных оснований, вначале оттитровываются ионы водорода, соответствующие первой ступени диссоциации, затем второй и т.д. при условии, что константы кислотности отличаются друг от друга в 10 000 раз.
На кривой титрования могут проявляться скачки для каждой последовательной ступени нейтрализации кислоты.
Разделение и отчётливое проявление этих скачков на кривой титрования зависит от величин констант последовательных ступеней диссоциации и от концентрации кислоты в титруемом растворе.
Если Кк< 10 – 6, то скачки на кривой титрования проявляются отчётливо.
Ортофосфорная кислота – трёхосновная:
К1 = 7,1·10–3; К2 = 6,2·10–8; К3 = 3·10– 13
Теоретически при взаимодействии фосфорной кислоты со щёлочью существуют три точки эквивалентности
Различие в константах ступенчатой диссоциации достаточно, чтобы скачки на кривой титрования разделились, но сами величины К2 и К3 малы. Поэтому даже при достаточной концентрации кислоты С> 10 –2
второй скачёк проявляется слабо, третий не проявляется (см. рис.5).
Поэтому фосфорную кислоту титруют как одноосновную с индикатором метиловым оранжевым, либо как двухосновную с индикатором фенолфталеином.
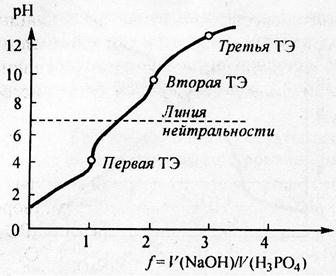
Рис.6. Рассчитанная кривая титрования раствора ортофосфорной кислоты H3PO4 с молярной концентрацией эквивалента 0,1 моль/л раствором гидроксида натрия с молярной концентрацией 0,1 моль/л; f – степень оттитрованности.
|
|
|
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 3274; Нарушение авторских прав?; Мы поможем в написании вашей работы!