
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Этапы количественного химического анализа
|
|
|
|
Классификация ошибок количественного анализа.
Ошибки количественного анализа условно подразделяют на систематические, случайные и грубые.
Грубые ошибки, обусловленные несоблюдением методики анализа, очевидны. Они устраняются при повторном проведении анализа с соблюдением всех требуемых условий, предусмотренных методикой анализа.
а) Систематическая ошибка
Различают: систематическую ошибку и процентную систематическую ошибку.
Систематическая ошибка результата анализа Δ0 — это статистически значимая разность между средним х–и действительным а (или истинным μ) значениями содержания компонента:
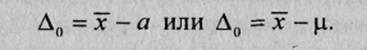
Систематическая ошибка результата анализа может быть больше нуля, меньше нуля или равна нулю.
Процентная систематическая ошибка (относительная величина систематической ошибки) — это систематическая ошибка, выраженная в процентах от действительного значения а (или истинного значения μ) определяемой величины:
δ = (х–– а)∙100% / а или δ = (х–– μ)•100% / μ (1.3)
Для относительной величины систематической ошибки вместо символа 5 используют также обозначение Δ0 %.
Систематическая ошибка характеризует правильность результатов анализа; поэтому правильность анализа можно определить так же, как качество анализа, отражающее близость к нулю систематической ошибки.
Систематические ошибки обусловлены либо постоянно действующими причинами (и поэтому они повторяются при многократном проведении анализа), либо изменяются по постоянно действующему закону, который можно учесть.
Так, например, процентная систематическая ошибка (Δс/с)•100% фотометрических определений (с — концентрация, Δс — систематическая ошибка определения концентрации фотометрическим методом) минимальна в интервале изменений оптической плотности А от А ≈ 0,2 до А ≈ 0,8 и составляет (Δс/с)•100% < 0,4%.
|
|
|
Источники систематических ошибок. Невозможно с исчерпывающей полнотой перечислить все источники систематических ошибок. Основными являются следующие.
Методические — обусловлены особенностями методики анализа. Например, аналитическая реакция прошла не до конца; имеются потери осадка вследствие его частичной растворимости в растворе или при его промывании; наблюдается соосаждение примесей с осадком, вследствие чего масса осадка возрастает, и т.д.
Инструментальные — обусловлены несовершенством используемых приборов и оборудования. Так, например, систематическая ошибка взвешивания на лабораторных аналитических весах составляет ±0,0002 г. Систематическая ошибка в титриметрических методах анализа вносится вследствие неточности калибровки бюреток, пипеток, мерных колб, цилиндров, мензурок и т.д.
Индивидуальные — обусловлены субъективными качествами аналитика. Так, например, дальтонизм может влиять на определение конечной точки титрования при визуальной фиксации изменения окраски индикатора.
В конечном итоге правильность результатов анализа определяется наличием или отсутствием именно систематических ошибок.
Существуют способы выявления систематических ошибок.
а) Использование стандартных, образцов. Общий состав стандартного образца должен быть близким к составу анализируемой пробы, а содержание определяемого компонента в стандартном образце должно быть точно известно.
Анализ стандартного образца — наиболее надежный способ выявления наличия или отсутствия систематической ошибки и оценки правильности результата анализа.
б) Анализ исследуемого объекта другими методами. Исследуемый объект анализируют методом или методами, которые не дают систематической ошибки (метрологически аттестованы), и сравнивают результаты анализа с данными, полученными при анализе того же объекта с использованием оцениваемой методики или не аттестованного оборудования. Сравнение позволяет охарактеризовать правильность оцениваемой методики анализа.
|
|
|
в) Метод добавок или метод удвоения — используют при отсутствии стандартных образцов и метрологически аттестованной методики (метода) анализа.
Анализируют образец, используя оцениваемую методику. Затем удваивают массу анализируемой пробы или увеличивают (уменьшают) массу в иное число раз, снова находят содержание определяемого компонента в уже новой пробе и сравнивают результаты анализов. Должна выполняться определенная закономерность (например, пропорциональность).
б) Случайные ошибки.
Случайные ошибки показывают отличие результатов параллельных определений друг от друга и фактически характеризуют воспроизводимость анализа. Причины случайных ошибок однозначно указать невозможно. При многократном повторении анализа они или не воспроизводятся, или имеют разные численные значения и даже разные знаки.
Случайные ошибки можно оценить методами математической статистики, если выявлены и устранены систематические ошибки (или систематические ошибки меньше случайных).
Наука об измерениях, методах и средствах обеспечения их единства и способах достижения требуемой точности называется метрологией. Количественный химический анализ, целью которого является определение содержания веществ в разных объектах, может рассматриваться как измерительная процедура, характеризующаяся рядом специфических особенностей.
Количественный химический анализ, прежде всего, является многостадийным процессом, включающим ряд этапов и стадий. При выполнении химического анализа с помощью любого метода можно выделить следующие основные этапы:
— постановка аналитической задачи;
— выбор метода анализа;
— выполнение анализа;
— оценка качества анализа;
— принятие решений по результатам анализа.
При постановке аналитической задачи необходимо дать характеристику объекта анализа, указать химическую формулу определяемого компонента, возможный интервал его содержаний, требуемую точность и продолжительность анализа.
|
|
|
Выбор метода анализа определяется поставленной аналитической задачей и техническими возможностями аналитической лаборатории.
Этап, связанный непосредственно с проведением химического анализа, наиболее трудоемок и включает ряд стадий, представленных на рис. 5.2.
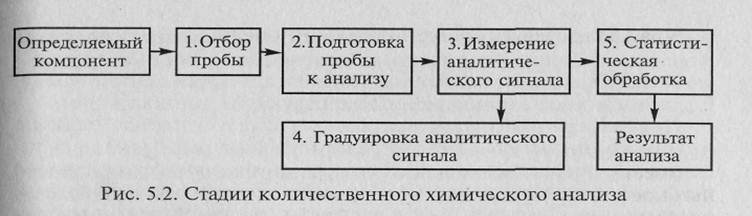 |
Методика анализа включает подробное описание последовательности и условий проведения всех стадий анализа. Точное следование методике анализа позволяет выполнить анализ с минимальными погрешностями на каждой стадии и получить правильный результат анализа.
Первая стадия химического анализа — отбор средней (представительной) пробы. Это небольшая часть анализируемого объекта, средний состав и свойства которой должны быть идентичны во всех отношениях среднему составу и свойствам объекта анализа. Содержание определяемого компонента в анализируемой пробе должно отражать среднее содержание этого компонента во всем исследуемом объекте, т. е. анализируемая проба должна быть представительной. Погрешность в отборе пробы часто определяет общую погрешность химического анализа. Не оценив погрешность на этой стадии, нельзя говорить о правильности определения компонента в анализируемом объекте.
Подготовка пробы к анализу включает ряд сложных операций, например, такие как высушивание пробы, разложение (вскрытие) пробы, устранение влияния мешающих компонентов. В зависимости от цели анализа, природы объекта и выбранного метода могут быть использованы разные модификации и комбинации этих операций. В правильном проведении химического анализа роль подготовки пробы настолько велика, что химик-аналитик должен каждый раз оценивать необходимость включения операций пробоподготовки в методику анализа, их влияние на общую погрешность анализа.
После отбора и подготовки пробы наступают стадии химического анализа, на которых определяют количество компонента. С этой целью измеряют аналитический сигнал. В большинстве методов им является среднее из измерений физической величины на заключительной стадии анализа, функционально связанной с содержанием определяемого компонента. Это может быть сила тока, ЭДС системы, оптическая плотность, интенсивность излучения и т.д. В отдельных методах анализа возможно непосредственное определение содержания. Например, в гравиметрическом методе иногда прямо измеряют массу определяемого компонента.
|
|
|
При определении количества компонента измеряют величину аналитического сигнала. Затем рассчитывают содержание компонента с использованием функциональной зависимости аналитического сигнала от содержания: у = f (с), которая устанавливается расчетным или опытным путем и может быть представлена в виде формулы, таблицы или графика. Содержание может быть выражено абсолютным количеством определяемого компонента в молях, в единицах массы или через соответствующие концентрации.
При измерении аналитического сигнала учитывают наличие полезного аналитического сигнала, являющегося функцией содержания определяемого компонента, и аналитического сигнала фона, обусловленного примесями определяемого компонента и мешающими компонентами в растворах, растворителях и матрице образца, а также «шумами» в измерительных приборах, усилителях и другой аппаратуре. Эти шумы не имеют отношения к определяемому компоненту, но накладываются на его собственный аналитический сигнал. Задача аналитика состоит в том, чтобы максимально снизить величину аналитического сигнала фона и, главное, сделать минимальными его колебания.
Обычно аналитический сигнал фона учитывают в контрольном (холостом) опыте, когда через все стадии химического анализа проводится проба, не содержащая определяемого компонента. Полезным при этом будет аналитический сигнал, равный разности измеренного сигнала и аналитического сигнала фона.
На основании существующей зависимости между аналитическим сигналом и содержанием находят концентрацию определяемого компонента. Обычно при этом используют методы градуированного графика, стандартов или добавок. Описанные в литературе другие способы определения содержания компонента, как правило, являются модификацией этих трех методов.
Наиболее распространен метод градуировочного графика: в координатах (аналитический сигнал – содержание компонента) строят график с использованием образцов сравнения с разными и точно известными уровнями содержания компонента (концентрация С). Затем, измерив величину аналитического сигнала в пробе, находят содержание определяемого компонента по градуировочному графику (рис. 5.3).
В методе стандартов измеряют аналитический сигнал в образце сравнения (стандартном образце) с известным содержанием компонента и в анализируемой пробе: Уст = sСст и ух = sСХ, где s-коэффициент пропорциональности.
Если определенное в идентичных условиях значение s заранее известно, то можно провести расчет по формуле Сх = Ух/S. Обычно же используют соотношение Уст/У Х = С ст /СХ, откуда
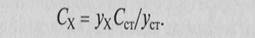
Иногда работают с двумя стандартными образцами, в которых содержание компонента отличается от предполагаемого содержания в анализируемой пробе в одном случае в меньшую, в другом — в большую сторону. Этот вариант метода стандартов называют методом ограничивающих растворов. Содержание определяемого компонента рассчитывают по формуле
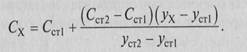
Если при определении малых количеств компонента нужно учесть влияние матрицы образца на величину аналитического сигнала, то часто используют методы добавок — расчетный или графический.
При определении содержания расчетным методом берут две аликвоты раствора анализируемой пробы. В одну из них вводят добавку определяемого компонента известного содержания. В обеих пробах измеряют аналитический сигнал — ух и ух+доб-
Неизвестную концентрацию определяемого компонента рассчитывают по формуле

где Vдоб и Сдоб — объем и концентрация добавленного раствора определяемого компонента; V — аликвота анализируемой пробы.
При определении содержания компонента графическим методом берут п аликвот анализируемой пробы: 1, 2, 3,..., п. Во 2-ю,..., п-ю аликвоты вводят известные, возрастающие, количества определяемого компонента. Во всех аликвотах измеряют аналитический сигнал и строят график в координатах аналитический сигнал -содержание определяемого компонента, приняв за условный нуль содержание определяемого компонента в аликвоте без добавки (аликвота 1). Экстраполяция полученной прямой до пересечения с осью абсцисс дает отрезок слева от условного нуля координат, величина которого в выбранном масштабе и единицах измерения соответствует Сх определяемого компонента (рис. 5.4).
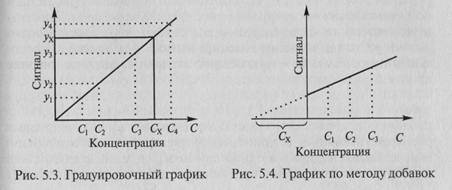
Метод стандартов и метод добавок применимы для линейной градуировочной функции. Метод градуировочного графика допускает использование как линейной, так и нелинейной функций аналитический сигнал—содержание. В последнем случае требуется большее число экспериментальных данных, и результат определения содержания компонента бывает, как правило, менее точным.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 3755; Нарушение авторских прав?; Мы поможем в написании вашей работы!